1. "Quelle est la différence entre une revue systématique et une revue traditionnelle?"
2."Une revue systématique Cochrane, c’est quoi ?"
3. “Quelle est la différence entre une revue systématique et une méta-analyse?”
4. “Comment savoir si une revue systématique est de bonne qualité?”
5. “Le biais de publication, c’est quoi?”
6. “Comment gérer le biais de publication dans une revue systématique?”
7. "Devrais-je effectuer une revue systématique dans le cadre de ma thèse de doctorat?"
8. "L'hétérogénéité, c’est quoi?"
9. "Comment gérer l'hétérogénéité?"
10. "Pourquoi dois-je rédiger un protocole pour ma revue systématique?"
11. "La littérature grise, c’est quoi?"
12. "Pourquoi rechercher la littérature grise dans le cadre de ma revue systématique?"
13. "La Librairie Cochrane, c’est quoi?"
14. "Cochrane CENTRAL, c’est quoi?"
15. "Quels sont les domaines pouvant faire l’objet d’une revue systématique?"
16. "Comment choisir la portée d’une revue systématique?"
17. "Une revue vide, est-ce utile?"
18. "Qu'est-ce qu'un forest plot?"
20. "La pertinence clinique, c’est quoi?"
21. "Comment interpréter un forest plot?"
22. "Comment interpréter une méta-analyse?"
23. "Que sont les critères PRISMA?"
24. "Qu'est-ce qu'un diagramme de flux (PRISMA)?"
25. "La cartographie des données, c’est quoi?"
27. "Comment formuler une recommandation à l’aide de GRADE ?"
28. "Logiciels de production de revues systématiques Cochrane - 1. Archie"
29. "Logiciels de production de revues systématiques Cochrane - 2. Review Manager"
30. "Logiciels de production de revues systématiques Cochrane - 3. Covidence"
31. "Logiciels de production de revues systématiques Cochrane - 4. GRADEpro GDT"
32. "Logiciels de production de revues systématiques Cochrane - 5. EPPI-Reviewer"
34. Que sont les revues systématiques "vivantes" ou "actualisées" (living systematic reviews) ?
35. Qu'est-ce qu'un « funnel plot » ou graphique en entonnoir ?
36. Comment interpréter un graphique en entonnoir (« funnel plot ») ?
37. Qu'est-ce qu'une méta-analyse en réseau ?
39. Risque de biais : ordre d’attribution aléatoire
40. Risque de biais : biais d’attribution
41.Risque de biais : patients et membres du personnel en insu
42. Risque de biais : l’insu des évaluateurs
43. Risque de biais : données sur les résultats incomplètes
44. Risque de biais : déclaration sélective
45. Risque de biais : autres sources
46. Que sont les opérateurs booléens ?
47. Que sont des opérateurs de proximité ?
48. Que sont les termes d’indexation ?
49. Quand utiliser des termes référant à un type de publication dans votre stratégie de recherche ?
50. Comment minimiser le risque de biais lors d’une recherche documentaire ?
51. Un indice de citations, c’est quoi ?
52. Que sont Scopus et Web of Science ?
53. Quelle est la différence entre Medline/PubMed et Embase?
54. Que sont Cinahl, PsycINFO et PsycNet ?
55. Pourquoi faire une recherche dans plusieurs bases de données ?
56. Des suggestions pour améliorer la qualité de ma recherche ?
57. L’outil de risque de biais 2 de Cochrane : quoi de neuf ?
58. L’outil de risque de biais 2 de Cochrane évalue le risque de biais dans les résultats plutôt que dans les études
59. L’outil de risque de biais 2 de Cochrane utilise des questions guidantes
60. L’outil de risque de biais 2 de Cochrane n’a plus l’option «non claire»
61. L’outil de risque de biais 2 de Cochrane. Domaine 1 : biais provenant du processus de randomisation
62. L’outil de risque de biais 2 de Cochrane. Domaine 2 : biais dû aux écarts par rapport aux interventions prévues
63. L’outil de risque de biais 2 de Cochrane. Domaine 3 : biais dû aux données manquantes
64. L’outil de risque de biais 2 de Cochrane. Domaine 4 : biais dus à des erreurs de mesure des résultats
65. L’outil de risque de biais 2 de Cochrane. Domaine 5 : biais induit par la sélection des résultats rapportés
66. À quoi doit ressembler une bonne liste de contrôle de sélection d’études ?
67. Avons-nous vraiment besoin de travailler en parallèle pour mener une bonne revue systématique, et au cours de quelles étapes est-ce le plus important ?
68. Que sont les normes MECIR ?
69. Les pièges des analyses en sous-groupes
70. La communauté Cochrane : groupes de revue Cochrane et leurs réseaux
71. La communauté Cochrane : les domaines Cochrane
72. La communauté Cochrane : Groupes de méthodes Cochrane
73. Nouveaux sujets dans le manuel Cochrane : la notion d’équité
74. Dois-je exclure de ma revue systématique les études qui ne rapportent aucun résultat pertinent ?
1."Quelle est la différence entre une revue systématique et une revue traditionnelle?"
Une revue donne un aperçu la littérature. Une revue systématique décrit toutes les démarches de manière transparente, de la question à la conclusion. Aussi la qualité de chaque étude incluse est évaluée, de sorte que le lecteur puisse se prononcer sur la fiabilité des conclusions. La méthodologie d’une revue traditionnelle, par contre, n'est généralement pas transparente. Ainsi, il n’est souvent pas clair si la revue inclut toutes les études pertinentes ou comment les auteurs sont arrivés à leur conclusion. Pourquoi alors encore publier des revues traditionnelles ?
Voir également: https://www.cochrane.org/what-is-cochrane-evidence
2. "Une revue systématique Cochrane, c’est quoi ?"
Les revues Cochrane sont des aperçus de la littérature fiables par rapport à une question de recherche bien précise ; elles sont fiables parce qu’elles sont menées rigoureusement selon les normes les plus sévères dans ce domaine. Cochrane est une organisation à but non lucratif dont les activités reposent sur l’enthousiasme de bénévoles partout dans le monde. Cochrane s’emploie à informer les patients, cliniciens et décideurs de sorte qu'ils puissent prendre des décisions éclairées. Une décision éclairée est basée sur des études scientifiques (et donc des revues systématiques) et non sur l’avis d'un médecin, des médias ou de quiconque.
Voir également: https://www.youtube.com/watch?v=AhtchOL1ofc
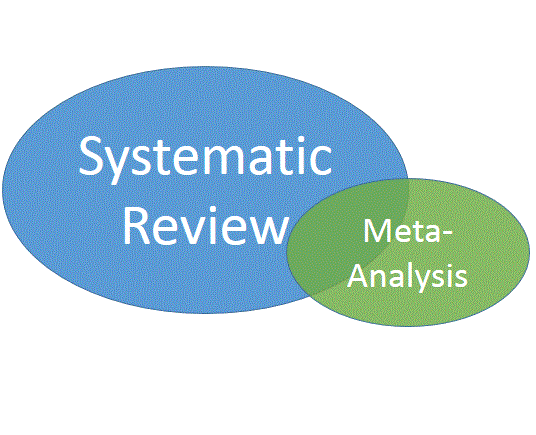
3. “Quelle est la différence entre une revue systématique et une méta-analyse?”
Ces termes sont parfois utilisés l’un pour l’autre, mais à tort. Une revue systématique se rapporte à une méthode d’aperçu de la littérature comprenant recherche et sélection systématiques, évaluation de la qualité des études et présentation transparente des résultats. La méta-analyse est une approche statistique visant à combiner les résultats des études séparées. Elle exprime en quelque sorte une valeur moyenne pour l’ensemble des études prises en compte. On peut à la fois réaliser une revue systématique et faire une méta-analyse. Par contre, faire une méta-analyse sans revue systématique n’a pas de sens.
4. “Comment savoir si une revue systématique est de bonne qualité?”
La liste de contrôle intitulée AMSTAR (A Measurement Tool to Assess systematic Reviews) se compose de 11 critères permettant d’apprécier la qualité d’une revue systématique. Les critères se rapportent à la manière dont la revue systématique a été menée, comme par exemple : le protocole a-t-il été rédigé au préalable, une vaste recherche a-t-elle eu lieu, le criblage et la sélection ont-ils été faits par deux personnes de façon indépendante, etc. Une revue systématique est de bonne qualité lorsqu’elle répond à tous les critères. L'outil AMSTAR peut également servir d’aide aux auteurs dans la réalisation de leur revue systématique.
Liste de contrôle AMSTAR: www.amstar.ca

5. “Le biais de publication, c’est quoi?”
Le biais de publication est une distorsion des résultats d'une revue systématique suite à une inclusion incomplète d’études. Nous savons que les études ayant des résultats négatifs, c'est-à-dire des études prouvant qu'un traitement particulier n’a pas d’effet, sont moins susceptibles d'être publiées. Ce genre d’études est donc plus difficile à retrouver et à inclure dans une revue systématique. Lorsqu’une revue systématique ne comprend pas un certain nombre d'études à résultats négatifs, le résultat global ne reflètera pas le véritable effet. Le biais de publication est le plus important point faible des revues systématiques.
Voir également: https://www.youtube.com/watch?v=UUk0zas0VL4
6. “Comment gérer le biais de publication dans une revue systématique?”
La méthodologie de revue appliquée visera à éviter le biais de publication autant que possible, entre autres en effectuant une recherche exhaustive. Il est important de faire une recherche dans différentes sources, y compris les registres d'essais. Lors de l’interprétation des résultats de votre revue systématique, vous devrez estimer la probabilité d’avoir manqué des études. Si un biais de publication est vraisemblable, il vous faudra diminuer votre confiance en la conclusion de la revue.
Le groupe de travail GRADE a mis au point un système permettant d'évaluer systématiquement ce type de biais, parmi d'autres. Voir : Évaluation de la qualité de la preuve: http://www.jclinepi.com/article/S0895-4356(11)00181-8/fulltext
7. "Devrais-je effectuer une revue systématique dans le cadre de ma thèse de doctorat?"
Cela va de soi ! Ce n’est pas sans raison que les bailleurs de fonds demandent de plus en plus qu’un projet de recherche repose sur une revue systématique. En effet, une revue systématique permet d’identifier ce qui est connu, les lacunes dans les connaissances et les écueils possibles dans les études menées précédemment. Par conséquent, une revue systématique est un excellent point de départ de n’importe quel projet de doctorat.
8. "L'hétérogénéité, c’est quoi?"
L'hétérogénéité signifie la variation ou les différences entre les études incluses dans une revue systématique. L’hétérogénéité est inhérente à une revue systématique puisqu’elle inclut de multiples études uniques. La variation entre les études peut avoir rapport aux caractéristiques des participants (p.ex. une étude inclut des adultes alors qu'une autre étude inclut des adultes d'au moins 65 ans), aux traitements (p.ex. une étude utilise comme traitement des comprimés alors qu'une autre utilise des injections) ou aux critères de jugement (p.ex. une étude examine chaque événement indésirable tandis qu'une autre ne prend en compte que les événements indésirables graves). C'est ce qu'on appelle l'hétérogénéité clinique. L’hétérogénéité statistique désigne la variabilité des résultats d'études (p.ex. une étude montre des effets favorables tandis qu'une autre pas).
Voir également: https://www.youtube.com/watch?v=KSKCTXciGjI

9. "Comment gérer l'hétérogénéité?"
Dans le cas d'une hétérogénéité clinique, c'est-à-dire lorsqu'il y a des différences entre les études au niveau des participants, des traitements ou des critères de jugement, il faudra décider si une méta-analyse s’avère nécessaire. Si vous estimez que les différences au niveau des caractéristiques des études n'auront aucun effet sur les résultats de l'étude, vous pouvez procéder à la mise en commun des résultats. Dans d'autres cas, la mise en commun n’est pas indiquée. Cette décision devra être prise par des experts cliniques.
Il sied de se pencher sur l'hétérogénéité statistique. D'abord, vous devez vérifier s’il en est question. Si oui, vous en mesurez l’ampleur. Dans le cas d’une importante hétérogénéité statistique, la méta-analyse devra, d’une façon ou d’une autre, en tenir compte.
Pour plus d’informations à ce sujet, voir: https://handbook-5-1.cochrane.org/ chapter 9.5 Heterogeneity
10. "Pourquoi dois-je rédiger un protocole pour ma revue systématique?"
Le protocole décrit les objectifs de votre revue. Cette description au préalable est essentielle pour ne pas dévier de ou modifier vos objectifs en fonction des études incluses dans la revue, ce qui risque de compromettre la qualité de votre revue. Une bonne revue est ouverte et objective à cet égard.
11. "La littérature grise, c’est quoi?"
La littérature grise se rapporte à tous les documents qui ne sont pas publiés dans des livres ou des revues. Il s’agit par exemple de thèses de doctorat, résumés de conférences, documents de travail et rapports techniques. Ce matériel n’étant pas contrôlé par l'édition commerciale, il n’est donc pas indexé dans les principales bases de données électroniques telles que Medline. C’est pourquoi la recherche de la littérature grise dans le cadre de votre revue systématique s’avère généralement plus difficile que de retrouver les études publiées.
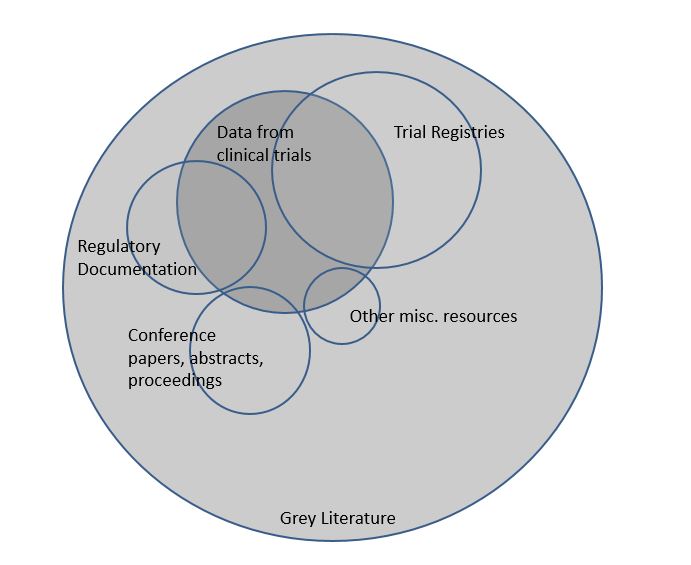
12. "Pourquoi rechercher la littérature grise dans le cadre de ma revue systématique?"
Cochrane recommande de faire une recherche dans les sources répertoriant la littérature grise, et ce dans le but de manquer le moins possible et de retrouver le plus possible d'études. En effet, nous savons que les études publiées montrent en moyenne des effets plus importants que les études non publiées. Ne pas tenir compte de la littérature grise pourrait donc influencer les résultats et la conclusion de votre revue.
Voir également : MECIR standard C28 https://community.cochrane.org/mecir-manual
13. "La Librairie Cochrane, c’est quoi?"
Pour mener à bien sa mission, c'est-à-dire soutenir la prise des décisions éclairées en matière de soins de santé, Cochrane dispose de plusieurs bibliothèques, actuellement six, proposant différents types de données probantes de haute qualité. Parmi celles-ci, on retrouve la Cochrane Database of Systematic Reviews (Base de données Cochrane de revues systématiques), contenant toutes les revues Cochrane finalisées et en cours.
La Librairie Cochrane est disponible sur www.thecochranelibrary.com

14. "Cochrane CENTRAL, c’est quoi?"
Cochrane CENTRAL est l'abréviation de Cochrane Central Register of Controlled Trials (régistre central Cochrane des essais contrôlés), une des bibliothèques Cochrane. Cette bibliothèque ne contient que des essais contrôlés randomisés et quasi-randomisés. Ce sont les bénévoles de Cochrane qui assurent la recherche de ce type d'essais dans plusieurs sources ; ceux-ci sont ensuite ajoutés dans CENTRAL, qui est la plus grande base de données d’essais. Si votre revue inclut des essais, il est donc judicieux de faire une recherche dans CENTRAL. La base de données ne contient que les résumés, et pas les articles complets.
Pour plus d'informations: http://www.cochranelibrary.com/about/central-landing-page.html
15. "Quels sont les domaines pouvant faire l’objet d’une revue systématique?"
Tous les domaines peuvent faire l’objet d’une revue systématique. Une revue systématique est un outil permettant de répondre à une question dans n’importe quel domaine ou champ d’intérêt. Pour certains domaines, cependant, il est préférable d’avoir une plus grande expertise méthodologique pour élaborer la revue. Ceci facilitera la tâche.
16. "Comment choisir la portée d’une revue systématique?"
La portée ou l’étendue d’une revue systématique peut être étroite, large ou entre les deux. Un exemple de revue systématique de large portée : « Exercices physiques pour patients souffrant de problèmes cardiaques ». Cette revue systématique tiendrait compte de tous les types d'exercices physiques existants et de tous les patients présentant une grande variété de problèmes cardiaques. La conclusion de cette revue sera bien évidemment très générale.
Les revues systématiques à portée étroite se concentrent sur des interventions ou populations spécifiques, par exemple : « Exercices dynamiques de la jambe pour fumeuses âgées ayant eu une crise cardiaque ». Ce genre de revues systématiques ne comprend généralement que quelques études ou parfois même aucune. La conclusion en sera très détaillée car s’applique uniquement à ce type d'exercice pour ce groupe de patients bien délimité. C’est généralement la pertinence clinique d'une question de recherche qui détermine la portée optimale d'une revue.
17. "Une revue vide, est-ce utile?"
Une revue dite vide (« empty review ») est une revue systématique n’ayant inclus aucune étude. Celle-ci peut être utile pour démontrer qu’il n’existe aucune étude (de bonne qualité) pour une question spécifique. Ceci peut encourager la réalisation de nouvelles études. Cependant, une telle revue est beaucoup moins utile si elle est la conséquence de l’application de critères d'inclusion très strictes (et qui ne correspondent pas à la pratique clinique).
18. "Qu'est-ce qu'un forest plot?"
Un « forest plot » (graphique en forêt) est une représentation graphique des résultats d’une méta-analyse. Il montre aussi bien les résultats individuels de chaque étude que le résultat global de la méta-analyse. Pour chaque étude le « forest plot » indique l'estimation de l'effet et l'intervalle de confiance. Le résultat combiné (résultats sommés) figure au bas du graphique, sous la forme d’un losange, qui représente l’évaluation de l'effet global et l'intervalle de confiance. On appelle le graphique « forest plot » parce que les lignes horizontales ressemblent aux branches d’un arbre.
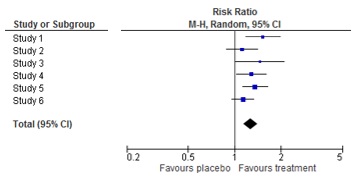
Plus d'informations sur l'origine des forest plots: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1120528/
19. "Les résultats de mon méta-analyse sont statistiquement significatifs. Qu'est-ce que cela signifie?"
Un résultat statistiquement significatif veut dire que les différences entre deux traitements, par exemple les résultats d'une méta-analyse, sont réelles et non attribuables au hasard ou à une coïncidence. Les tests statistiques calculent la probabilité qu’un résultat repose sur le hasard. Plus cette probabilité est petite, plus grande sera la probabilité que les résultats soient réels. Une différence est statistiquement significative lorsque la probabilité que les résultats soient attribuables au hasard est inférieure à 5%, ce qui est exprimé par une valeur p de 0,05.
Des résultats statistiquement significatifs ne sont pas pour autant des résultats importants.
20. "La pertinence clinique, c’est quoi?"
La pertinence clinique indique ce qui est important pour le patient. Certains effets sont si infimes que le patient ne remarquera même pas la différence. Pour évaluer la pertinence clinique, les patients doivent interpréter l’ampleur de l'effet : est-elle suffisamment importante pour faire une différence ? Il n’existe pas de moyen pour déterminer quels sont les résultats cliniquement pertinents. Cela dépend du résultat, du patient et de la pathologie.
Pour interpréter une méta-analyse, il faudrait évaluer séparément la signification statistique et la pertinence clinique des résultats.
Plus d'informations sur la signification statistique et la pertinence clinique: https://www.students4bestevidence.net/statistical-significance-vs-clinical-significance/
21. "Comment interpréter un forest plot?"
Identifiez d’abord quels groupes ou traitements sont comparés.
Repérez ensuite les mesures de résultat et comment elles sont documentées.
Identifiez en troisième lieu comment le forest plot est organisé : quel côté du forest plot montre un avantage du traitement ?
En quatrième lieu, déterminez le nombre d’études et de patients inclus dans le graphique, et la signification des résultats des études individuelles.
À l’aide de ces informations, vous pouvez consulter les résultats de la méta-analyse. Ce sera le sujet de la semaine prochaine.
22. "Comment interpréter une méta-analyse?"
Pour interpréter les résultats de la méta-analyse, vérifiez le sens de l'effet : est-ce que l'estimation combinée indique que le traitement est supérieur ou inférieur à celui auquel il est comparé ?
En second lieu, identifiez la précision du résultat de la méta-analyse, ou la largeur de l'intervalle de confiance. L'effet est-il statistiquement significatif ? Si oui, l'effet est-il aussi cliniquement pertinent ?
Enfin, vérifiez s’il est question d’hétérogénéité entre les études.
23. "Que sont les critères PRISMA?"
PRISMA est l’abréviation de “Preferred Reporting Items for Systematic Reviews and Meta-Analyses”. Il s’agit d’une liste de contrôle comprenant 27 critères indiquant comment chaque critère doit être documenté. Cette liste permet aux auteurs de revues systématiques et de méta-analyses de documenter leur travail de manière transparente. Les éditeurs de journaux demandent de plus en plus aux auteurs de tenir compte de ces critères avant soumission de leur revue pour publication. La déclaration PRISMA apparaît dans plusieurs publications, par exemple dans:
http://journals.plos.org/plosmedicine/article?id=10.1371/journal.pmed.1000100
24. "Qu'est-ce qu'un diagramme de flux (PRISMA)?"
Un diagramme de flux fournit de manière standardisée un aperçu graphique des résultats de la recherche effectuée dans le cadre d’une revue systématique. Il documente le nombre d’articles qui ont été identifiés, combien ont finalement été inclus dans la revue et toutes les étapes intermédiaires. Il est recommandé de produire un tel diagramme pour chaque revue systématique. Voir aussi la Declaration PRISMA (Q23).
25. "La cartographie des données, c’est quoi?"
La cartographie des données (ou « evidence mapping ») est l'un des plus récents types de revues systématiques. Ces revues visent à identifier les lacunes dans les connaissances ou les futurs besoins de recherche. Propre à la cartographie des données est la recherche systématique d'un vaste domaine. Les résultats sont généralement présentés sous un format pratique, avec ou sans aide visuelle, telle qu’une figure, un graphique ou une base de données. La méthodologie de ces revues n'en est qu'à ses premiers balbutiements.
26. "Qu'est-ce que GRADE?"
GRADE est l'acronyme pour Grading of Recommendations Assessment, Development and Evaluation. Il s’agit d’une méthode transparente qui permet d’évaluer la confiance que nous avons dans les données probantes («grading quality of evidence») et la force des recommandations reprises dans des revues systématiques et guides de pratique clinique. De nombreux chercheurs et organisations internationales ont contribué à cette méthode. Elle est considérée comme la référence pour évaluer les effets des interventions. L'approche GRADE peut également être utilisée pour les données probantes concernant les tests de diagnostic.
Plus d'informations sur: http://www.gradeworkinggroup.org/
27. Comment formuler une recommandation à l’aide de GRADE ?
La méthodologie GRADE permet de formuler 4 types de recommandations : forte en faveur d’une intervention, faible en faveur d’une intervention, faible contre une intervention et forte contre une intervention. Une recommandation forte signifie que tous les patients bénéficient de l'intervention, alors qu'une recommandation faible reflète le fait que certains patients, mais pas tous, devraient recevoir l'intervention.
La recommandation munie d’un GRADE reflète le degré de certitude que les avantages d'une intervention l'emportent sur les inconvénients. Le choix du type de recommandation dépend de l'équilibre entre les effets de l’intervention et ses effets secondaires, la qualité de la preuve scientifique, les préférences et les valeurs des patients et l'utilisation des ressources.
28. Logiciels de production de revues systématiques Cochrane - 1. Archie
Au cours des prochaines semaines, nous mettrons en évidence les outils recommandés pour produire des revues systématiques Cochrane.
Archie est une base de données en ligne destinée aux auteurs de revues Cochrane, qui archive toutes les versions préliminaires des revues. Tous les co-auteurs d'une revue ont accès à cette base de données et donc à la version la plus récente de la revue. Cet outil permet de travailler conjointement sur la même revue d'une manière efficace. De plus, Archie contient les coordonnées de tous les auteurs.
29. Logiciels de production de revues systématiques Cochrane - 2. Review Manager
Review Manager (RevMan) est un logiciel permettant aux auteurs de revues systématiques d'effectuer et d'écrire des revues systématiques répondant aux critères de qualité Cochrane. Le logiciel fournit un format servant à toutes les étapes du processus : la rédaction du protocole, l’évaluation du risque de biais, la réalisation de méta-analyses et la rédaction de la revue. RevMan produit également des schémas illustrant les résultats de la revue.
RevMan a été développé pour les revues systématiques d’interventions dans le domaine des soins de santé. De nos jours, il existe également une version pour revues systématiques qui se rapportent à la fiabilité de tests de diagnostic. Cochrane s’emploie actuellement à développer une version Internet de RevMan qui sera dès lors continuellement mise à jour et perfectionnée.
Plus d'informations sur https://community.cochrane.org/tools/review-production-tools/revman-5
30 Logiciels de production de revues systématiques Cochrane - 3. Covidence
Covidence est un logiciel qui aide à élaborer une revue systématique, en accompagnant les auteurs dans certaines démarches telles que le screening des articles retenus (sur la base du titre et l'abrégé) et des textes intégraux des articles sélectionnés, ce genre de tâches n’étant pas possible dans RevMan. Ce logiciel basé sur le Web permet également le screening en double et la résolution de conflits durant le screening, et facilite le travail à plusieurs auteurs sur la même revue.
Le logiciel soutient d'autres étapes d’une revue systématique telles que l'évaluation du risque de biais des études et l’encodage des données issues des études, par exemple les caractéristiques de l'étude et les résultats. Il est possible d’exporter les données et références vers Review Manager.
Plus d'informations sur https://community.cochrane.org/tools/review-production-tools/covidence
31 Logiciels de production de revues systématiques Cochrane - 4. GRADEpro GDT
Le logiciel GRADEpro Guideline Development Tool (GDT) aide à résumer et à présenter les informations nécessaires à la prise de décisions en matière de santé. Ces résumés d'informations sont présentés de façon transparente, et permettent aux patients et aux cliniciens de prendre une décision éclairée pour ou contre une intervention de soins de santé.
Spécifiquement pour les revues Cochrane, GRADEpro GDT permet de dresser des tableaux récapitulatifs des résultats des études. Ces tableaux présentent pour chaque critère de jugement, l’ensemble des résultats et des données probantes exprimés en chiffres relatifs et absolus, ainsi que leur niveau de qualité. Il est possible d’importer dans GRADEpro GDT les données provenant de Review Manager, de les convertir en un tableau récapitulatif des résultats, et de réimporter celui-ci dans Review Manager.
Plus d'informations sur https://community.cochrane.org/tools/review-production-tools/gradepro-gdt
32 Logiciels de production de revues systématiques Cochrane - 5. EPPI-Reviewer
EPPI-Reviewer est un logiciel de soutien à la réalisation de tout type de revue systématique. En ce qui concerne les revues Cochrane, il permet principalement de faciliter les revues avec analyses complexes, y compris des analyses comparatives qualitatives, des synthèses thématiques qualitatives et ce qu’on appelle des « framework synthesis » (cadre théorique de synthèse). L’accès au logiciel est gratuit pour auteurs de revues Cochrane.
Le logiciel assiste dans plusieurs étapes d'une revue systématique, telles que la gestion des références, la sélection des études, l'extraction simultanée et indépendante des données, l'analyse quantitative et qualitative et la présentation des données.
Plus d'informations sur https://community.cochrane.org/tools/review-production-tools/eppi-reviewer
33 Logiciels de production de revues systématiques Cochrane - 6. Task Exchange
Task Exchange n'est pas un logiciel en tant que tel mais plutôt une plate-forme qui permet d’entrer en contact avec d'autres personnes.
Task Exchange relie les personnes ayant besoin d’une aide dans la réalisation de leur revue systématique et celles ayant l’expertise et souhaitant les aider. N’importe quelle « tâche » peut être postée sur la plate-forme, par exemple demande d’aide à la traduction, demande de feed-back de la part de cliniciens ou de patients, demande d’aide à l'extraction de données ou à l’évaluation et au développement de guides de bonne pratique clinique. Il est également possible de recommander une personne qui vous a aidé à effectuer une tâche.
Plus d'informations sur: https://community.cochrane.org/tools/review-production-tools/taskexchange
34 Que sont les revues systématiques "vivantes" ou "actualisées" (living systematic reviews) ?
Une revue systématique dite vivante ou actualisée est un nouveau genre de revues systématiques. Il s’agit de revues systématiques mises à jour dès apparition de nouvelles études. L'objectif est de maintenir à jour les revues systématiques ou de raccourcir le délai entre la publication des études et leur inclusion dans les revues systématiques, tout en utilisant les meilleures méthodes pour élaborer la revue.
Ce type de revue est particulièrement pertinent pour les sujets :
- pour lesquels il existe une incertitude significative par rapport aux données probantes,
- pour lesquels de nouvelles données probantes (études) apparaîtront bientôt, d’après la publication de protocoles d'études dans les registres d'essais et
- avec une question de recherche importante pour la pratique clinique ou la politique des soins de santé.
Un webinaire Cochrane à ce sujet est disponible sur : https://training.cochrane.org/resource/introducing-living-systematic-reviews
35 Qu'est-ce qu'un « funnel plot » ou graphique en entonnoir ?
Un graphique en entonnoir est un diagramme utilisé dans les méta-analyses permettant de vérifier l'existence d'un biais. Il visualise pour chaque étude sur l’axe X la taille de l'effet (par exemple le rapport des cotes (odds ratio)) et sur l’axe Y la taille ou la précision de l'étude, généralement exprimée comme l’erreur-type.
Chaque point de la figure ci-dessous représente une étude. Les plus vastes études se caractérisent par de plus petites erreurs-types. On les retrouve en haut de la figure. Les études plus restreintes se situent au milieu de la figure et les plus petites études au bas. En l’absence de biais, ce sera la variation au niveau des caractéristiques des échantillons d'étude qui expliquera la variation entre les résultats des études. Cette variation étant aléatoire, les résultats seront répartis de manière égale autour des résultats des vaste études. Les points forment alors une pyramide ou un entonnoir inversé.
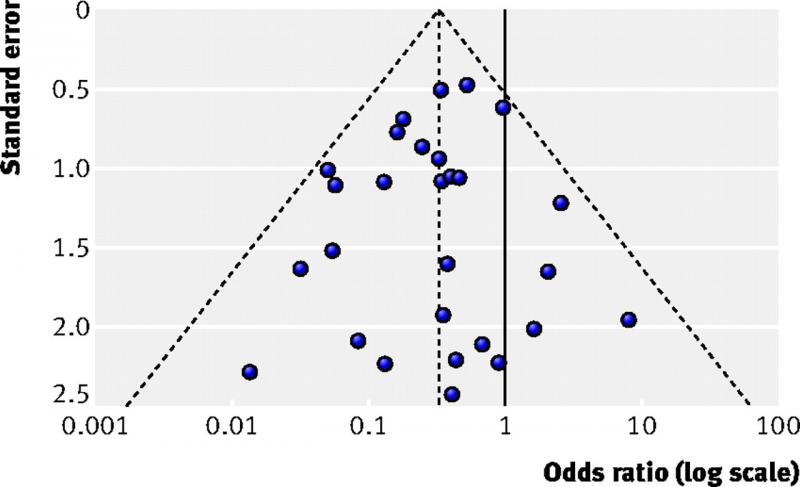
La semaine prochaine, nous décrirons comment il faut interpréter un graphique en entonnoir.
Pour plus d'informations : Sterne JAC et al. Recommendations for examining and interpreting funnel plot asymmetry in meta-analyses of randomised controlled trials. BMJ 2011;343:d4002
36 Comment interpréter un graphique en entonnoir (« funnel plot ») ?
Dans les revues systématiques d’études interventionnelles, un graphique en entonnoir asymétrique est parfois considéré comme révélant un biais de publication. Or, ce n'est pas toujours le cas. Un graphique en entonnoir asymétrique peut être le résultat :
• d’un biais de déclaration, c'est-à-dire qu’il est plus probable que des résultats significatifs suggérant un effet positif soient publiés que des résultats non significatifs ;
• d’une hétérogénéité réelle, c'est-à-dire que les résultats diffèrent entre les sous-groupes (cf figure ci-dessous) ;
• de problèmes méthodologiques, conduisant à l'amplification des résultats des petites études ;
• du hasard, principalement lorsque peu d'études ont été incluses à la revue systématique.
En cas d’asymétrie du graphique, il sied, en plus d’un graphique en entonnoir, d’effectuer des tests statistiques. Ces tests ont une faible puissance, faisant en sorte qu’en cas de test négatif un biais ne puisse être exclu. Voici quelques recommandations générales concernant les tests d'asymétrie d’un graphique :
• Décrivez dans le protocole comment vous avez l’intention de tester l'asymétrie du graphique.
• N'effectuez ces tests que si votre revue systématique comprend au moins 10 études.
• Interprétez les résultats des tests au moment de l'inspection visuelle du graphique.
• En cas d'asymétrie, considérez le biais de publication comme l'une des raisons.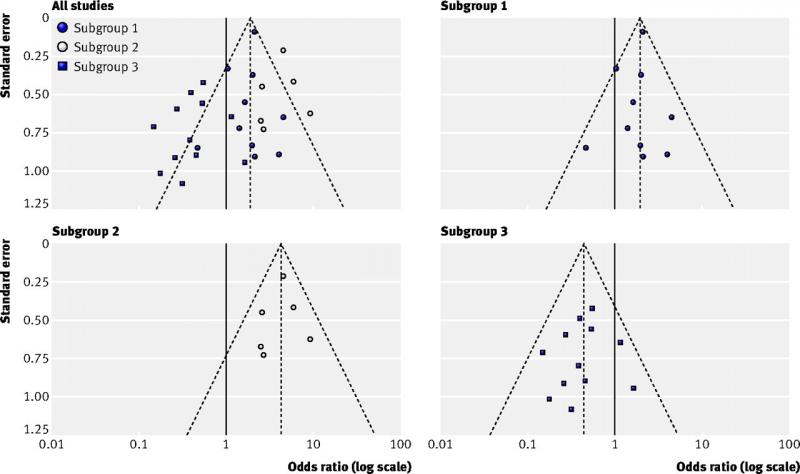
Figure en haut à gauche (toutes les études) : exemple d'un graphique en entonnoir asymétrique dû à une hétérogénéité réelle
Les autres figures (sous-groupes 1, 2 et 3) représentent les résultats des trois sous-groupes qui expliquent l'asymétrie (Source : Sterne et al, 2011)
Pour plus d’informations : Sterne JAC et al. Recommendations for examining and interpreting funnel plot asymmetry in meta-analyses of randomized controlled trials. BMJ 2011;343:d4002
Cochrane Handbook for Systematic Reviews of Interventions. Chapter 10.4.1 Funnel plots
37 Qu'est-ce qu'une méta-analyse en réseau ?
Les méta-analyses en réseau comparent les effets de différents traitements pour une même pathologie. Les méta-analyses traditionnelles par contre ne comparent que deux traitements entre eux. Les méta-analyses en réseau permettent donc d’évaluer différents traitements pour une même affection et de déterminer quel est le traitement le plus efficace.
Quelles sont les principes ?
Nombreuses études comparent un traitement avec un placebo, tandis que d'autres études comparent deux traitements. Les méta-analyses en réseau peuvent comprendre toutes les données probantes dans une seule analyse, aussi bien les preuves directes qu’indirectes (voir figure infra). Une preuve directe provient d'études comparant un traitement A à un traitement B. Une preuve indirecte provient de deux types d'études : celles comparant un traitement A à un traitement C (par exemple placebo) et celles comparant un traitement B à un traitement C. En soustrayant les effets des deux études, il est possible d’estimer l'effet de A par rapport à B, en assumant que le traitement C est comparable entre toutes les études. Le résultat est un réseau d'effets entre toutes les interventions possibles étayé par des preuves directes et indirectes.
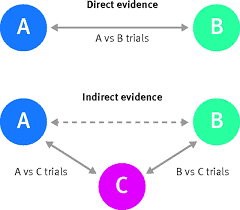
Voir métrages:
https://training.cochrane.org/resource/introduction-network-meta-analysis-nma
Figures:
BMJ (BMJ 2017;358:j3932)
Cochrane (http://www.cochranelibrary.com/app/content/special-collections/article/?doi=10.1002/(ISSN)14651858(CAT)Freeaccesstoreviews(VI)networkmetaanalysis)
Les prochaines semaines, nous nous concentrerons sur les domaines de l'outil de risque de biais de Cochrane. Cet outil représente l'étalon-or pour l’évaluation du risque de biais des essais contrôlés randomisés dans les revues systématiques d’interventions.
39 Risque de biais : ordre d’attribution aléatoire
L’essai contrôlé randomisé est un type d’étude idéal pour examiner les effets d’interventions. La procédure de randomisation garantit des facteurs pronostiques analogues, et donc deux groupes similaires au départ.
La première étape d'une procédure de randomisation appropriée consiste à générer un ordre aléatoire. Cette liste spécifie l'ordre d’attribution des participants. Le principe clé d'une randomisation adéquate est que personne ne peut prédire quel traitement le prochain participant recevra.
Si l'on peut prévoir à quel groupe le prochain patient sera attribué, le risque de biais est réel suite à une possible modification de la procédure de sélection. Ainsi les patients peuvent être inclus de manière sélective ou pas du tout si le traitement suivant ne leur convient pas, ce qui compromet une inclusion équilibrée et peut conduire à des disparités entre les groupes.
Une méthode inadéquate est par exemple générer un ordre aléatoire sur base de la date de naissance ou du jour de la semaine. Une méthode adéquate sont par exemple des listes de nombres aléatoires ou des listes aléatoires générées par ordinateur.

40 Risque de biais : biais d’attribution
La seconde étape d'une procédure de randomisation appropriée consiste à cacher aux personnes impliquées dans l'étude la séquence d'attribution utilisée. Cela signifie que les participants et les chercheurs ignorent quel traitement le prochain participant recevra.
Si l'on peut prévoir à quel groupe le prochain patient sera attribué, le risque de biais est réel suite à une possible modification de la procédure de sélection. Ainsi les patients peuvent être inclus de manière sélective ou pas du tout si le traitement suivant ne leur convient pas, ce qui compromet une inclusion équilibrée et peut conduire à des disparités entre les groupes.
Une procédure de randomisation adéquate consiste par exemple en une attribution centralisée, où la personne ayant recruté le participant contacte un centre indépendant ou une personne indépendante qui se charge de la prochaine attribution. Ceci peut se faire par téléphone, par Internet ou réalisée par un pharmacien.
Une procédure de randomisation inadéquate est par exemple l’emploi d’enveloppes peu protégées, comme des enveloppes non scellées, transparentes ou avec une numérotation non séquentielle.
41 Risque de biais : patients et membres du personnel en insu
Dans un essai contrôlé randomisé, plusieurs (groupes de) personnes peuvent être en insu. Ce domaine porte sur l’insu des patients et des prestataires de soins.
L’absence d’insu peut influencer la réponse des participants à l’intervention étudiée, comme par exemple du fait que le groupe-témoin attend moins de l’intervention. Il peut y avoir des différences systématiques entre les groupes, par ex. dues aux abandons, co-interventions ou procédures de suivi. Un insu efficace garantit que les deux groupes obtiennent la même quantité d’attention, de traitement auxiliaire et d’examens diagnostiques.
Le risque de biais peut être élevé pour certains critères de jugement et faible pour d'autres. L’absence d’insu par exemple peut avoir un effet sur l'évaluation de la qualité de vie, mais moins sur la mortalité. C’est pourquoi le risque de biais par manque d'insu doit être évalué pour chaque critère de jugement séparément.
42 Risque de biais : l’insu des évaluateurs
L'insu des évaluateurs est un domaine spécifique de l'outil de risque de biais Cochrane. Ces évaluateurs effectuent les mesures de base et les mesures des résultats d’études. Si ceux-ci sont au courant du traitement que reçoit un certain participant, leurs jugements peuvent être biaisés. Ce risque de biais est plus important, mais pas uniquement, dans le cas de critères de jugement subjectifs, tels qu’une démarche diagnostique basée sur des radiographies et des scintigraphies.
Dans certaines études, la mise en insu des évaluateurs est impossible. Cela ne signifie cependant pas qu’il ne faut pas y prêter attention. Les auteurs de revues systématiques doivent toujours examiner si les évaluateurs ont été mis en insu, et si ce n’est pas le cas, juger si cela aurait pu entraîner un biais.
43 Risque de biais : données sur les résultats incomplètes
Le terme « données sur les résultats incomplètes » signifie qu’il manque des données dans l’étude p. ex. du fait que des patients ont abandonné l’étude (sorties d’études) ou ont été exclus de l’étude après randomisation. Certaines exclusions sont justifiées, par ex. parce que le patient a déménagé. Ces exclusions doivent par contre avoir lieu avant la mesure des résultats.
Le risque de biais relatif aux données sur les résultats incomplètes dépend de plusieurs facteurs, dont les suivants :
- Combien de patients ont-ils abandonné l’étude/ été exclus de l’étude ?
- Ces nombres, sont-ils équilibrés entre les groupes ?
- Quelles sont les raisons des sorties d’études/des exclusions ?
- Y a-t-il une différence entre les résultats des patients avec ou sans données ?
- Comment interpréter les résultats manquants dans un contexte clinique ?
Le risque de biais est faible quand les raisons de l'absence de données sont documentées de manière suffisamment détaillée et que les données manquantes sont équilibrées entre les groupes. Lorsque les raisons des sorties d’études ne sont décrites qu'en termes généraux, il est difficile d'évaluer leurs impact. Les patients refusent-ils de participer parce qu'ils ne veulent par exemple pas pratiquer des exercices dans le groupe intervention ou parce que les conseils à ne pas pratiquer des exercices dans le groupe témoin leur déplaisent ?
Une simple affirmation qu’une analyse en intention de traiter (« intention to treat» ou « ITT ») a eu lieu ne suffit pas pour conclure à un faible risque de biais, car le terme ITT n'a pas de définition cohérente. Une vraie analyse en intention de traiter respecte 3 principes :
- Les participants restent dans les groupes auxquels ils ont été randomisés, peu importe l'intervention qu'ils ont reçue en réalité.
- La mesure des données sur les résultats tient compte de tous les participants.
- L’analyse comprend tous les participants randomisés.
Le risque de biais est élevé si les sorties d’études ont un lien avec les résultats de l'étude, par ex. lorsque les personnes plus malades ont plus tendance à abandonner. L'exclusion de patients en raison d'un «échec du traitement» peut introduire un biais quand les nombres ne sont pas équilibrés entre les groupes de traitement.
Pour plus d'informations, consulter le chapitre 8.13 du Manuel Cochrane (https://handbook-5-1.cochrane.org/)
44 Risque de biais : déclaration sélective
La déclaration sélective fait référence au fait que pas toutes les variables d’une étude sont déclarées. Il s’agit d’une source potentielle de biais, car elle se rapporte généralement à des résultats non significatifs. Des méta-analyses faisant abstraction des résultats non publiés risquent donc de surestimer l'effet des interventions.
Les situations suivantes sont des exemples de déclaration sélective. Un risque de biais peut survenir lorsque les résultats non significatifs sont omis de manière sélective.
- déclaration sélective des résultats d'une étude ;
- choix sélectif de données d’un résultat :
- Certains résultats sont rapportés utilisant plusieurs mesures, ou mesurés à différents moments.
- déclaration sélective d’analyses qui emploient les mêmes données :
- Il existe différentes méthodes pour analyser les données, par exemple le rapport des résultats finaux ou plutôt des changements par rapport à la base de référence.
- Les données continues, par exemple l'échelle EVA de la douleur, peuvent être rapportées sous forme de valeur moyenne ou sous forme d’un seuil (le nombre de personnes ayant un score d'au moins 6).
- déclaration sélective de sous-ensembles de données :
- Certains critères de jugement, comme par exemple l'échelle de qualité de vie SF-36, donnent des scores totaux, mais aussi plusieurs sous-échelles.
- sous-déclaration sélective de résultats de sorte qu’ils ne peuvent pas être utilisés dans une méta-analyse:
- Certains articles déclarent que "les résultats n'étaient pas significatifs".
Pour évaluer un risque de biais potentiel, les auteurs devraient rechercher le protocole de la revue et le comparer avec la revue intégrale.
45 Risque de biais : autres sources
L'instrument Cochrane pour l'évaluation du risque de biais permet également de décrire d’"autres sources de biais". Les versions antérieures du manuel Cochrane considéraient l'arrêt prématuré d'une étude comme un exemple d'une source de biais. Cependant, de nouvelles preuves soutiennent que l'arrêt prématuré d'une étude ne conduit pas nécessairement à un biais.
La version révisée du manuel Cochrane recommande de n’utiliser ce domaine que dans des cas exceptionnels. S'il est utilisé, l'élément doit se rapporter à un problème qui entraîne directement un biais. Par exemple, une étude peut avoir d'autres problèmes dans la conception qui peuvent engendrer un biais.
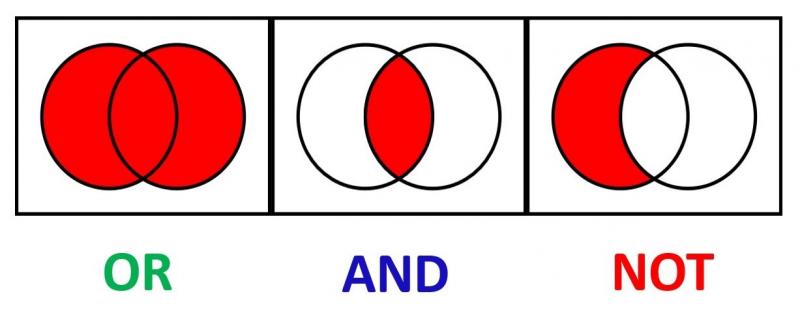
46 Que sont les opérateurs booléens ?
Les opérateurs booléens sont des mots pouvant être utilisés pour définir une stratégie de recherche (systématique). Ces mots relient plusieurs termes de recherche avec l'intention de trouver soit des résultats plus spécifiques, soit des résultats plus larges. Les plus connus sont les mots «AND», «OR» et «NOT».
La question de recherche «exercice physique ‘OR’ arthrose du genou» résulte en des articles qui contiennent les termes «exercice physique» ou «arthrose du genou», générant ainsi des résultats plus larges.
La question de recherche «exercice physique ‘AND’ arthrose du genou» résulte en des articles qui contiennent à la fois le terme «exercice physique» et «arthrose du genou», générant ainsi des résultats plus spécifiques.
La question de recherche «exercice physique ‘NOT’ arthrose du genou» exclut les articles portant sur l'arthrose du genou. Cette recherche résulte en des articles sur l'activité physique, sans inclure ceux sur l'arthrose du genou.
47 Que sont des opérateurs de proximité ?
Des opérateurs de proximité sont des termes permettant de rechercher deux mots qui peuvent être combinés dans l'intention d'obtenir des résultats plus spécifiques. Chaque base de données connaît ses propres opérateurs de proximité. Ci-dessous quelques exemples de la base de données Cochrane.
Le terme ‘near’, comme dans par exemple ‘prostate near cancer’, permet de rechercher toutes les revues contenant les mots ‘prostate’ et ‘cancer’ séparés par maximum 6 mots. L'ordre des mots n'a pas d'importance. L’on obtient ainsi aussi bien ‘cancer de la prostate’ que ‘cancer de la prostate et de l'intestin’. Il est possible de spécifier le nombre de mots séparant les deux mots recherchés en utilisant 'near/x' où x représente le nombre de mots.
Le terme ‘next’ permet de spécifier l’ordre des deux mots de recherche. Ainsi la recherche 'prostate next cancer' n’affiche que les revues où le mot 'prostate' précède le mot 'cancer'.
Pubmed n'a pas d'opérateurs de proximité.
48 Que sont les termes d’indexation ?
Les termes d'indexation sont des termes standardisés que les bases de données utilisent pour indexer de nouveaux articles. Dans de nombreuses bases de données, telles que MEDLINE, Cochrane et Embase, il est possible de faire des recherches à l’aide de termes d'indexation. Les termes MeSH, ou «Medical Subject Headings», sont les plus connus. Ceux-ci sont utilisés dans MEDLINE et Cochrane. Les termes Emtree sont utilisés dans Embase.
Les termes d'indexation sont utiles pour une recherche de revues systématiques, car permettent de trouver des articles utilisant d’autres termes pour décrire le même sujet.
Une stratégie de recherche composée uniquement de termes d'indexation ne permettra probablement pas de trouver tous les articles pertinents, étant donné que l’assignation des termes d'indexation par les bases de données n’est pas standardisée. De plus, les articles les plus récents ne sont pas encore pourvus de termes d'indexation.
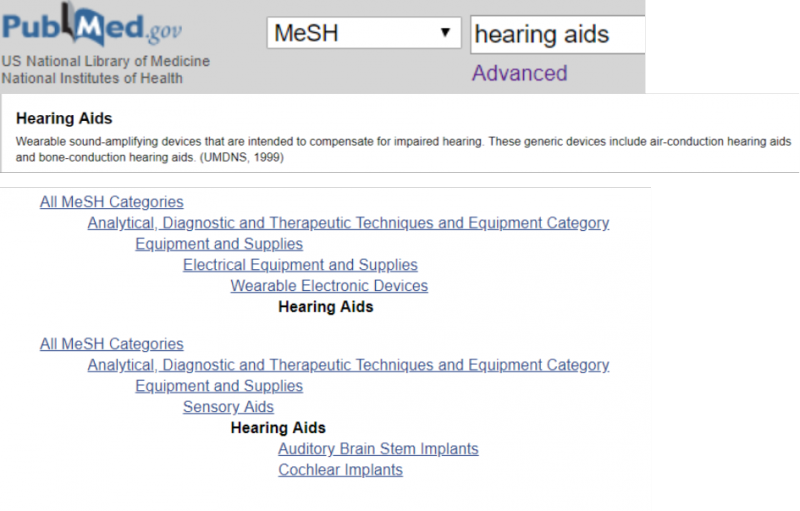
49 Quand utiliser des termes référant à un type de publication dans votre stratégie de recherche ?
Le type de publication est une des catégories proposées par la base de données MeSH, qui permet de faire la distinction entre par exemple une recherche d’articles d’études randomisées et une recherche d’articles portant sur des études randomisées. Un article décrivant les résultats d'une étude contrôlée randomisée se voit attribuer le type de publication « Randomized Controlled Trial », tandis que les articles portant sur des essais contrôlés randomisés recevront le terme « Randomized Controlled Trials as Topic ». Ce principe s'applique également aux termes faisant référence à d'autres types d'études.
50. Comment minimiser le risque de biais lors d’une recherche documentaire ?
Les revues systématiques demandent une vaste recherche documentaire afin d'identifier autant d'études pertinentes que possible. Cette stratégie réduit le risque de biais de sélection dans les études retracées. Cette vaste recherche documentaire est une des caractéristiques qui permet de faire la distinction entre une revue systématique et une revue dite narrative. Elle augmente la probabilité d’obtenir des résultats fiables.
Pour minimiser le risque de biais lors d’une recherche documentaire, Cochrane recommande d'effectuer la recherche dans plusieurs bases de données, au moins dans le registre Cochrane des essais contrôlés (CENTRAL), et si nécessaire aussi dans Medline et Embase (si on estime que le registre Cochrane ne couvre pas la totalité de la recherche). Cochrane recommande également de parcourir les registres d'essais et de faire un contrôle des listes bibliographiques des études pertinentes pour identifier des revues systématiques. En fonction du sujet et des possibilités, il peut en outre être utile de faire une recherche de la littérature grise, de contacter d’autres chercheurs, de consulter d’autres bases de données (nationales, régionales ou portant sur des thèmes spécifiques) ou d’examiner les listes bibliographiques d’autres revues sur des sujets connexes.
Voir également les normes MECIR (‘Methodological Expectations of Cochrane Reviews of Interventions’, C24-C32) : MECIR manual
51. Un indice de citations, c’est quoi ?
Un indice de citations est une base de données d'articles publiés contenant des liens vers d'autres articles citant ces premiers articles, comme par exemple Web of Science, Scopus et Google Scholar.
En élaborant une revue systématique, on peut faire des recherches documentaires dans les indices de citations comme bases de données sources. Grâce aux liens, il est en outre possible de retrouver de deux manières d’autres études potentiellement pertinentes, et ce partant d’une étude déjà incluse dans la revue systématique. Les indices de citations permettent d’une part de consulter les études (plus anciennes) citées dans cette étude, et d'autre part les études (plus récentes) citant cette étude. La vérification des citations est une méthode de recherche utile, qui s’ajoute aux recherches documentaires dans les bases de références bibliographiques.
52. Que sont Scopus et Web of Science?
Scopus est une base de données de citations (cf. indices de citations, le thème de la semaine dernière) contenant à la fois des résumés d'études et des citations d’autres articles. Scopus est surtout axée sur la médecine sociale, mais répertorie également des articles sur la médecine.
Web of Science est la base de données en ligne appartenant à l’indice de citations Science Citation Index, anciennement connue sous le nom de ‘Web of Knowlegde’. Cette collection de bases de données scientifiques s’oriente principalement sur la littérature anglophone à fort impact relative aux sciences et à la technologie.
Google Scholar est encore une autre base de données de citations contenant toutes sortes d’informations ne provenant pas de revues scientifiques.
Ces bases de données en quoi diffèrent-elles ? Elles diffèrent par exemple par rapport au nombre de disciplines, d’études internationales et non anglophones et autres types d’informations qu’elles couvrent, telles que les rapports et les thèses de doctorat. La bibliothèque de l'Université d'Iowa State a comparé les trois bases de données : https://bit.ly/2wwiuP3
Mais quelle est maintenant la base de données à utiliser dans le cadre de votre revue systématique ? Il n’y a pas de réponse simple à cette question. Cela dépend principalement de votre sujet. Il est conseillé de les utiliser toutes et de voir le résultat.
53 Quelle est la différence entre Medline/PubMed et Embase?
Medline est une base de données contenant des revues biomédicales et des revues sur les sciences de la vie, publiées par l'American Medical Library. La base de données est principalement destinée aux professionnels de la santé, notamment aux chercheurs, aux prestataires de soins de santé, aux enseignants, au personnel administratif et aux étudiants. PubMed, qui en est le moteur de recherche, est accessible gratuitement, tandis qu’OVID, l'autre moteur de recherche de Medline, n’est accessible que par abonnement.
Embase est une base de données européenne de revues biomédicales et de résumés de conférences, publiée par Elsevier. Elle est fortement axée sur la pharmacologie, avec des revues sur la recherche médicamenteuse (allant du développement jusqu’à la vente en passant par les phases de test) et la toxicologie. Le système d'indexation d’Embase, à savoir EMTREE, est également plus sensible à la recherche d'articles sur des sujets pharmacologiques.
54 Que sont Cinahl, PsycINFO et PsycNet ?
Cinahl et PsycINFO sont des bases de données de revues portant sur un thème particulier. Pour entreprendre une recherche documentaire dans ces bases de données, il vous faut un abonnement.
Cinahl est principalement axée sur les soins infirmiers et sur d’autres disciplines paramédicales telles que la kinésithérapie, l'ergothérapie, l'orthophonie, la nutrition et la diététique.
PsycINFO est particulièrement utile dans le cadre d’une recherche documentaire dans le domaine de la psychologie, et plus particulièrement les sciences comportementales et les sciences sociales. PsycNet est la plateforme développée par l’American Psychological Association (APA) qui vous permet de faire une recherche dans la base de données PsycINFO. Cette base de données contient également d'autres sources d'informations telles que des livres et des vidéos.
55 Pourquoi faire une recherche dans plusieurs bases de données ?
Pour améliorer la qualité de votre revue systématique, il est souhaitable d’entreprendre une recherche documentaire dans plusieurs bases de données. Comme expliqué auparavant, il existe des différences entre les bases de données, par exemple au niveau des thèmes traités, et donc aussi au niveau des revues et autres sources possibles couvrant ces thèmes et au niveau de l’indexation et de la citation de leurs articles. La recherche dans différentes bases de données augmente la probabilité de trouver des études plus pertinentes.
L’intérêt de cette approche est illustré par les normes MECIR (Methodological Expectations of Cochrane Intervention Reviews) pour l’élaboration d’une revue Cochrane. Ces normes stipulent que «la recherche documentaire devrait être aussi complète que possible afin de réduire le risque de biais de publication et d’identifier autant de preuves pertinentes que possible».
56 Des suggestions pour améliorer la qualité de ma recherche ?
Dans le cadre d’une revue systématique, il n’est pas nécessaire d’effectuer une recherche documentaire par deux personnes séparément. Ce double travail est par contre recommandé dans d'autres étapes, comme lors de la sélection des études pour inclusion ou lors de l’évaluation du risque de biais.
Il est cependant utile de demander à un bibliothécaire ou à un spécialiste de l'information avec une expertise particulière en matière de revues systématiques d’examiner votre stratégie de recherche. Cet examen par des pairs permet d’identifier des erreurs de recherche. Le bibliothécaire peut aussi faire des suggestions par rapport à la sélection des termes de recherche, ce qui peut résulter en plus d’études trouvées. La ligne directrice PRESS (Peer Review of Electronic Search Strategies) peut vous aider à ce sujet. Pour plus d'informations : PRESS statement

57 L’outil de risque de biais 2 de Cochrane : quoi de neuf ?
Cochrane a revu son outil d'évaluation du risque de biais dans les études randomisées contrôlées (ERC). La nouvelle version de l’outil connu sous le nom ‘RoB 2.0’ est maintenant disponible et se caractérise par 5 innovations clés, dont chacune sera commentée au cours des 5 prochaines semaines.
L'outil RoB 2 :
1. évalue le risque de biais de résultats distincts au lieu du risque de biais d'une étude dans son ensemble ;
2. est composé de 5 domaines regroupant les principales sources de biais. Il n'est pas possible d'ajouter de nouveaux domaines ;
3. utilise des questions orientantes pour rendre l'outil plus pratique et plus transparent ;
4. comprend des questions auxquelles il est possible de répondre par «oui», «probablement oui», «probablement non», «non» et «pas d’information». Il n’est plus possible de répondre par «incertain»;
5. permet de se prononcer par un jugement global formel sur le risque de biais.
Vous trouverez des wébinaires intéressant sur : risk of bias 2
Pour plus d'informations sur l'outil : riskofbias.info
58 L’outil de risque de biais 2 de Cochrane évalue le risque de biais dans les résultats plutôt que dans les études
L’outil de risque de biais de Cochrane révisé se concentre sur les résultats uniques d’études qui comparent deux interventions par rapport à un critère de jugement précis. Étant donné que les études rapportent généralement plusieurs résultats, il faudra plusieurs évaluations du risque de biais pour chaque étude. Actuellement, il n'y a pas de recommandations indiquant le nombre d’évaluations à réaliser par étude. Une bonne indication est l’évaluation des résultats décrits dans le tableau du « Résumé des conclusions »
59 L’outil de risque de biais 2 de Cochrane utilise des questions guidantes
Le nouvel outil comprend cinq domaines susceptibles de générer un risque de biais pour un résultat d'étude. Pour chaque domaine, des questions ont été définies permettant d'évaluer ce risque et de vérifier si l’étude applique des critères importants pour éviter le biais. Un exemple : « la séquence d’allocation était-elle aléatoire » ? Ces questions visent à rendre l'utilisation de cet outil plus pratique et plus transparente.
Chaque question peut être répondue par « oui », « probablement oui », « probablement non », « non » ou « pas d’information ». Si la réponse est claire, on y répondra par « oui » ou par « non ». Dans d’autres cas, dans le cadre d’une évaluation, on choisira plutôt « probablement oui » ou « probablement non ».
Le nouvel outil contient des algorithmes qui guident l’utilisateur dans le domaine et lui proposent une évaluation globale du risque de biais dans un domaine.
60 L’outil de risque de biais 2 de Cochrane n’a plus l’option «non claire»
On répondra aux questions guidantes du nouvel outil, si possible, par «oui», par «non», par «probablement oui» ou par «probablement non». Contrairement à la première version de l’outil, l’option de réponse «peu clair» [unclear] a été supprimée. Lorsqu’une étude ne fournit pas suffisamment de détails pour permettre un jugement, on peut répondre par «pas d’information».
Dans certains cas, il est toutefois possible de faire un jugement raisonnable même si certaines informations manquent. Par exemple, lorsque la méthode de randomisation d’un essai randomisé de grande envergure n’est pas détaillée, la question concernant le secret d’attribution sera plutôt répondue par «probablement oui», réponse qui semble plus précise que «pas d’ information».
61 L’outil de risque de biais 2 de Cochrane. Domaine 1 : biais provenant du processus de randomisation
Le processus de randomisation est important, car permet d’être certain que les deux groupes sont comparables au début de l'étude. Il y a 3 questions guidantes pour ce domaine :
1. La séquence d'allocation était-elle aléatoire ?
2. La séquence d'allocation était-elle dissimulée jusqu'à inscription et répartition des participants aux interventions ?
3. Les différences de base entre les groupes d’intervention suggéraient-elles un problème au niveau du processus de randomisation?
Le nouvel outil propose un algorithme permettant d’évaluer le risque de biais résultant du processus de randomisation.
Source : riskofbias.org
62 L’outil de risque de biais 2 de Cochrane. Domaine 2 : biais dû aux écarts par rapport aux interventions prévues
Les écarts par rapport aux interventions envisagées sont importants car peuvent conduire à des différences systématiques entre les soins réellement prodigués et les soins devant être prodigués (selon le protocole de l'étude).
L’évaluation de ce domaine dépend de l’objectif de la revue : a-t-elle pour but de quantifier l’effet de l’intention de traiter (l’effet de l’allocation à une intervention) ou de plutôt mesurer l’effet par protocole (l’effet de la réalisation d’une intervention).
Les questions guidantes pour ce domaine sont :
- les participants et les personnes réalisant l’intervention ignoraient-ils le contenu de l’intervention ?
- les auteurs de l'étude ont-ils analysé leurs résultats de manière appropriée ?
Il est possible de conclure à un faible risque de biais dans ce domaine si on peut répondre par ‘oui’ aux deux questions sus mentionnées. S’il s’avère que les participants et les personnes réalisant l’intervention étaient au courant du contenu de l’intervention, il est nécessaire de procéder à une évaluation plus approfondie des écarts possibles.
Source : riskofbias.org
63 L’outil de risque de biais 2 de Cochrane. Domaine 3 : biais dû aux données manquantes
L’impact de données manquantes est important car donne lieu à des analyses qui n'incluent pas tous les participants. Il est question de biais si la cause des données manquantes est liée à la valeur réelle du résultat.
L’absence de biais n’est certaine que lorsque le résultat est mesuré chez tous les participants ou lorsque le nombre de données manquantes est si restreint que l’impact est trop faible pour être significatif. Dans n’importe quelle autre situation, il convient d’évaluer pourquoi certaines données manquent et d’en vérifier leur impact.
Les éléments à évaluer dans ce domaine sont les suivants :
• De combien de données manquantes s’agit-il dans chaque groupe ?
• L’absence de biais du résultat final est-elle prouvée ?
• Les données manquantes sont-elles susceptibles d’avoir un lien avec la valeur réelle du résultat ?
Contrairement à la version antérieure de l'outil de risque de biais, ce domaine n'évalue pas les participants qui sont exclus des analyses. Cet aspect est désormais couvert par le domaine « biais dû aux écarts par rapport aux interventions envisagées ».
Source : riskofbias.org
64 L’outil de risque de biais 2 de Cochrane. Domaine 4 : biais dus à des erreurs de mesure des résultats
Les erreurs de mesure des résultats affectent l'estimation de l'effet de l'intervention. De telles erreurs conduisent souvent à des biais s'il existe une différence systématique dans la méthode de mesure des résultats entre le groupe d'intervention et le groupe témoin. La mise en aveugle des personnes mesurant les résultats permet de réduire ce risque.
Ce domaine évalue la façon dont les résultats sont mesurés :
1. Les études randomisées contrôlées doivent utiliser des critères de jugement appropriés. Il ne s'agit pas d’évaluer le choix de ces critères de jugement, mais d’évaluer la fiabilité et la validité de leur mesure.
2. Les résultats doivent être mesurés de la même manière dans les deux groupes.
3. Il est important de savoir si la personne qui a mesuré le résultat était à l’insu (pas au courant de l'intervention). Si ce n'était pas le cas et que l'intervention était connue, ce domaine estime si la mesure peut en être influencée et quelle en est la probabilité.
Source : riskofbias.org
65 L’outil de risque de biais 2 de Cochrane. Domaine 5 : biais induit par la sélection des résultats rapportés
Un important changement mis en œuvre dans le nouvel outil est qu’il permet d’évaluer le risque de biais pour un résultat rapporté. Ce cinquième domaine estime si ce résultat a été privilégié parmi d’autres résultats mesurés et analysés dans l’étude. Le fait de favoriser un résultat par rapport à d’autres peut conduire à un biais si celui-ci a été sélectionné en fonction de son ampleur, de sa direction ou de sa signification statistique. Ce domaine ne comprend pas l’évaluation du risque de rapport incomplet des résultats. Dans ce cas, les résultats relatifs à un critère de jugement donné ne sont pas déclarés du tout, même si cela a été fait de manière sélective.
Les questions guidantes vous permettent de vérifier si le résultat a été sélectionné parmi d’autres mesures de résultats (telles que la douleur mesurée à l'aide de l’échelle visuelle analogue (EVA) et du questionnaire McGill sur la douleur), à plusieurs moments ou lors de plusieurs analyses des données (telles que des données non ajustées par rapport aux données ajustées, de la valeur finale par rapport à la différence d’une valeur par rapport à la valeur de base).
Source : riskofbias.org
66 À quoi doit ressembler une bonne liste de contrôle de sélection d’études ?
Une bonne liste de contrôle de sélection d’études décrit les critères pour tous les éléments importants se rapportant à la question de recherche. Ces critères permettent aux examinateurs de déterminer si une étude est incluse ou non dans l'analyse. Les éléments essentiels pour les revues d’intervention sont la description :
1) de la population de patients;
2) de l'intervention;
3) du contrôle.
La liste de contrôle décrit chaque critère de manière claire et explicite, aidant ainsi deux examinateurs travaillant de façon indépendante à prendre la même décision concernant une étude potentiellement pertinente. Cette liste de contrôle fait partie du protocole et devrait être prête avant d’entamer la revue systématique. Il indique également si les critères de jugement font partie du processus de sélection ou non, car ce n'est pas toujours le cas. Voir aussi les critères MECIR : C5-13 (https://bit.ly/2RcIRBW).

67 Avons-nous vraiment besoin de travailler en parallèle pour mener une bonne revue systématique, et au cours de quelles étapes est-ce le plus important ?
Préparer et élaborer une revue systématique demande de nombreuses décisions. Pour réduire le risque de commettre des erreurs, il est possible de travailler en parallèle pour certaines parties de la revue. Ce mode de travail restreint également la possibilité que les convictions d'un seul examinateur affectent les décisions, ce qui peut donner lieu à un biais.
Dans le cadre d’une revue Cochrane, il est obligatoire de travailler en parallèle lorsqu’il faut prendre des décisions par rapport à l'inclusion des études et à l’extraction des résultats. Cette manière de travailler est en outre fortement recommandée lors de l'extraction des caractéristiques de l'étude (critères MECIR : C39, C45, C46). Travailler en parallèle augmente la qualité de votre revue systématique.
68 Que sont les normes MECIR ?
MECIR est l'abréviation de ‘Methodological Expectations of Cochrane Intervention Reviews’. Il s’agit de normes méthodologiques pour les protocoles, les revues et les mises à jour de Cochrane décrivant comment mener et rédiger une revue systématique d’études interventionnelles.
Ces normes donnent aux auteurs de revues systématiques Cochrane des instructions claires et transparentes par rapport à toutes les étapes du processus. Elles sont également utiles aux auteurs de revues non-Cochrane car décrivent comment mener une revue systématique de haute qualité.
Pour plus d'informations: https://methods.cochrane.org/mecir

69 Les pièges des analyses en sous-groupes
Les analyses de sous-groupes visent à étudier l’hétérogénéité, par exemple, si l'effet d'une intervention varie en fonction de certaines caractéristiques de la population telles que l'âge ou en fonction des caractéristiques de l'intervention telles que la dose. Elles permettent également de répondre à des questions de recherche axées sur des groupes spécifiques de participants ou d'interventions.
Ce type d’analyses pose toutefois quelques problèmes importants :
- Les études rapportent rarement les résultats pour des sous-groupes de participants, par ex. l'effet sur le groupe de personnes appartenant à une certaine tranche d’âge. De nombreuses études ne peuvent donc pas être utilisées dans les méta-analyses de sous-groupes standard.
- Les analyses de sous-groupes font partie de la recherche observationnelle, étant donné qu’elles ne sont plus basées sur une comparaison aléatoire.
- Plus le nombre d'analyses de sous-groupes est important, plus le risque sera élevé d’obtenir des résultats faussement positifs ou faussement négatifs.
En raison de ces pièges, les résultats d’analyses de sous-groupes peuvent être trompeurs. Interpréter ces résultats comme étant très certains, peut conduire à des recommandations de pratique erronées. Les patients risquent, dans ce cas, de recevoir des traitements n’ayant pas d’effet ou de ne pas recevoir des traitements qui sont en réalité efficaces.
Il faut prévoir les analyses de sous-groupes au préalable dans le protocole et les interpréter avec beaucoup de prudence. Pour examiner les différences entre les sous-groupes, Cochrane recommande une approche statistique formelle.
Source: Deeks JJ, Higgins JPT, Altman DG (editors) on behalf of the Cochrane Statistical Methods Group. Chapter 9: Analysing data and undertaking metaanalyses. In: Higgins JPT, Churchill R, Chandler J, Cumpston MS (editors), Cochrane Handbook for Systematic Reviews of Interventions version 5.2.0 (updated June 2017), Cochrane, 2017. Available from www.training.cochrane.org/handbook.

70 La communauté Cochrane : groupes de revue Cochrane et leurs réseaux
Si vous souhaitez rédiger une revue systématique Cochrane, il faut prendre contact avec le groupe de revue qui s’aligne le mieux à votre question de recherche. Les groupes de revue sont composés de personnes offrant un soutien aux auteurs de revue au niveau de la préparation, du maintien et de la mise à jour de revues Cochrane. Leur tâche est de fournir des commentaires sur trois produits d'une revue : le titre, le protocole et la revue finale. Ils vérifient par exemple si la revue est pertinente pour les personnes qui doivent prendre une décision par rapport à une intervention particulière et si la revue répond aux exigences que pose Cochrane. Les groupes de revue se consacrent à des domaines de santé particuliers.
Les réseaux des groupes de revue relient les différents groupes de revue dans le but d'accroître l'efficacité des revues Cochrane et d’aviser sur l’opportunité de réalisation d’une revue Cochrane traitant de questions de recherche qui importent aux décideurs.
Voici les huit réseaux Cochrane et les groupes de revue correspondants.
- Acute and Emergency Care: Acute Respiratory Infections; Anaesthesia; Bone, Joint and Muscle Trauma; Emergency and Critical Care, Injuries
- Brain, Nerves and Mind: Common Mental Disorders; Dementia and Cognitive Improvement; Developmental, Psychosocial and Learning Problems; Drugs and Alcohol, Epilepsy; Movement Disorders; Multiple Sclerosis and rare Diseases of the CNS; Neuromuscular; Schizophrenia
- Cancer: Breast cancer; Childhood Cancer; Colorectal cancer; Gynaecological; Neuro-oncology and Orphan cancers; Haematological and Malignancies; Lung cancer; Urology cancer
- Children and families: Cystic Fibrosis and Genetic Disorders; Fertility Regulation; Gynaecology and Fertility; Incontinence; Neonatal; Pregnancy and Childbirth; Sexually Transmitted Infections
- Circulation and Breathing: Airways; Heart; Hypertension; Stroke; Vascular
- Long-term conditions and Ageing: Hepato-Biliary; Inflammatory Bowel Disease; Kidney and Transplant; Metabolic and Endocrine Disorders; Upper GI and Pancreatic Diseases
- Musculoskeletal, Oral, Skin and Sensory: Back and Neck; Ear, Nose and Throat; Eyes and Vision; Musculoskeletal; Oral Health; Pain, Palliative and Supportive Care; Skin; Wounds
- Public Health and Health Systems: Consumers and Communication; Effective Practice and Organization of Care; Infectious Diseases; Public Health; Tobacco Addiction; Work
71 La communauté Cochrane : les domaines Cochrane
Cochrane comprend 11 domaines thématiques axés sur des dimensions des soins de santé plus larges, telles que le cadre des soins (soins primaires), le type de consommateur (enfant, personne âgée) ou le type de prestataire (personnel infirmier).
Ces domaines visent à promouvoir Cochrane en tant que source de données probantes et à améliorer la diffusion des revues Cochrane au sein d’un domaine spécifique. Ils facilitent également l’échange de connaissances et d’idées. Ces domaines peuvent évoluer et devenir un réseau mondial de parties prenantes et d'individus impliqués dans la production, la diffusion et la mise en œuvre de processus de soins factuels.
Ces domaines sont :
- Cochrane Child Health
- Cochrane Complementary Medicine
- Cochrane Consumer Network
- Cochrane First Aid
- Cochrane Global Ageing
- Cochrane Insurance Medicine
- Cochrane Neurosciences
- Cochrane Nursing Care
- Cochrane Nutrition
- Cochrane Pre-hospital and Emergency Care
- Cochrane Primary Care
- Cochrane Rehabilitation
https://www.cochrane.org/about-us/our-global-community/fields
72 La communauté Cochrane : Groupes de méthodes Cochrane
Les groupes de méthodes Cochrane développent des méthodologies spécifiques pour les revues Cochrane. Par exemple, lorsque vous souhaitez vous concentrer sur les événements indésirables d’un traitement ou inclure des preuves qualitatives ou la notion d’équité dans votre revue. Les sites Internet des groupes de méthodes pertinents fournissent de nombreuses informations utiles. Vous pouvez également vous adresser à ces groupes avec des questions spécifiques. Il existe actuellement 17 groupes :
- Adverse Effects Methods Group
- Bias Methods Group
- Comparing Multiple Interventions Methods Group
- Economics Methods Group
- Equity Methods Group
- GRADEing Methods Group
- Information Retrieval Methods Group
- IPD Meta-Analysis Methods Group
- NRS for Interventions Methods Group
- Patient Reported Outcomes Methods Group
- Priority Setting Methods Group
- Prognosis Methods Group
- Prospective Meta-Analysis Methods Group
- Qualitative and Implementation Methods Group
- Rapid Reviews Methods Group
- Screening and Diagnostic Tests Methods Group
- Statistics Methods Group
https://www.cochrane.org/about-us/our-global-community/methods-groups
73 Nouveaux sujets dans le manuel Cochrane : la notion d’équité
Les inégalités en santé sont des différences systématiques en santé observées au sein de ou entre certains groupes de personnes. Ces différences ont un impact plus important sur ceux qui sont défavorisés. L'inégalité en matière de santé est évitable et injuste. Un bel exemple d’inégalité en matière de santé sont les différences socio-économiques au niveau des taux d'asthme chez les enfants, qui sont dues à la répartition inégale des polluants atmosphériques. L’augmentation de l’équité en matière de santé est un objectif politique important.
De plus en plus, les auteurs intègrent la notion d’équité dans leur revue systématique. Ils peuvent, par exemple, déjà en tenir compte lors de la définition de leur question de recherche ou en vérifier les implications pour leur Résumé des résultats (« Summary of Findings »). Le groupe de méthodes ‘Equité’ fournit des informations utiles sur la façon d’intégrer la notion d’équité dans une revue systématique. La dernière version du manuel Cochrane consacre un chapitre à la notion d’équité et est également intéressant (accessible aux personnes ayant un compte Archie). Est-il envisageable d’intégrer la notion d’équité dans votre revue ?

74 Dois-je exclure de ma revue systématique les études qui ne rapportent aucun résultat pertinent ?
Il n’y a pas lieu d’exclure des revues systématiques les études ne rapportant aucun résultat pertinent (voir également la norme MECIR C8). Le fait de ne pas citer certains résultats ne signifie pas forcément qu’ils n’ont pas été mesurés. Il se peut que d’autres informations relatives à d'autres résultats soient disponibles auprès des auteurs.
Ceci concerne le biais de mention des résultats (« outcome reporting bias ») ; il s’agit d’un biais découlant du fait que des résultats statistiquement significatifs sont plus susceptibles d’être mentionnés que des résultats statistiquement non significatifs. Le biais de mention des résultats compromet fortement la validité des revues systématiques.

