1. "Wat is het verschil tussen een systematische en een traditionele review?"
2. "Wat zijn Cochrane Systematische Reviews?"
3. “Wat is het verschil tussen een systematische review en een meta-analyse?”
4. “Hoe weet ik of een systematische review van goede kwaliteit is?"
6. “Hoe omgaan met publicatie bias in een systematische review?”
7. "Is het een goed idee om een systematische review te doen als deel van een doctoraatsthesis?"
9. "Wat kan ik doen aan heterogeniteit?"
10. "Waarom moet ik vooraf een protocol schrijven voor mijn systematische review?"
11. "Wat is grijze literatuur?"
12. "Waarom moet ik grijze literatuur zoeken voor mijn systematische review?"
13. "Wat is de Cochrane Library?"
14. "Wat is Cochrane CENTRAL?"
15. "Welke domeinen zijn geschikt om een systematische review te maken?"
16. "Hoe bepaal ik het bereik van mijn review?"
17. "Zijn lege reviews nuttig?"
19. "Het resultaat van mijn meta-analyse is statistisch significant. Wat betekent dit nu?"
20. "Wat wordt bedoeld met klinische relevantie?"
21. "Hoe interpreteer je een forest plot?"
22. "Hoe interpreteer je een meta-analyse?"
23. "Wat is de PRISMA checklist?"
24. "Wat is een (PRISMA) flowchart?"
25. "Wat is evidence mapping?"
27. "Hoe GRADE toepassen, ofwel de kwaliteit van bewijs graderen?"
28. "Hoe een aanbeveling formuleren met GRADE?"
29. "Software voor Cochrane reviews– 1. Archie"
30. "Software voor Cochrane reviews- 2. Review Manager"
31. "Software voor Cochrane reviews- 3. Covidence"
32. "Software voor Cochrane reviews- 4. GRADEpro GDT"
33. "Software voor Cochrane reviews-5. EPPI-Reviewer"
34. "Software voor Cochrane reviews-6. Task Exchange"
35. "Wat zijn levende systematische reviews?"
37. "Hoe een funnel plot interpreteren?"
38. "Wat is een netwerk-meta-analyse?"
39. "Risico op bias: willekeurige volgorde van toewijzing"
40. "Risico op bias: verbergen van de toewijzing"
41. "Risico op bias: blindering patiënten en personeel"
42. "Risico op bias: blindering van beoordelaars"
43. "Risico op bias: onvolledige uitkomstdata"
44. "Risico op bias: selectieve rapportage"
45. "Risico op bias: andere bronnen"
46. "Wat zijn booleaanse operatoren?"
47. "Wat zijn proximity-operatoren?"
49. "Wanneer gebruik je publicatietype-termen in je zoekstrategie?"
50. "Hoe kun je het risico op bias in de zoekactie minimaliseren?"
51. "Wat zijn citatie-indexen?"
52. "Wat is Scopus en Web of Science?"
53. "Wat is het verschil tussen Medline/PubMed en Embase?"
54. "Wat zijn Cinahl, PsycINFO en PsycNet?"
55. "Waarom doorzoek ik best meerdere databanken?"
56. Andere suggesties om de kwaliteit van mijn zoekstrategie te verbeteren?"
57. Wat is nieuw aan de Cochrane risk of bias tool 2?
58. Cochrane risk of bias 2 tool beoordeelt bias in resultaten in plaats van studies
59. Cochrane risk of bias 2 tool gebruikt signaliseringsvragen
60 Cochrane risk of bias 2 tool heeft geen optie ‘onduidelijk’ meer
61. Cochrane risk of bias tool 2. Domein 1: bias voortkomend uit het randomisatieproces
62. Cochrane risk of bias tool 2. Domein 2: bias door afwijking van de geplande interventies
63. Cochrane risk of bias tool 2. Domein 3: bias door ontbrekende gegevens
64. Cochrane risk of bias tool 2. Domein 4: bias door fouten in de meting van de uitkomsten
65. Cochrane risk of bias tool 2. Domein 5: bias door selectie van het gerapporteerde resultaat
66. Hoe ziet een goed studieselectie-formulier eruit?
67. Moeten we echt in parallel werken om een goede systematische review te maken, en in welke stappen van de review is dit het belangrijkst?
68. Wat zijn de MECIR-standaarden?
69. Valkuilen bij subgroepanalyses
70. Cochrane gemeenschap: Cochrane reviewgroepen en hun netwerken
71. Cochrane gemeenschap: Cochrane velden
72. Cochrane gemeenschap: Cochrane methode groepen
73. Nieuwe onderwerpen in het Cochrane Handboek: billijkheid (equity)
74. Moet ik studies die geen relevante uitkomsten rapporteren uitsluiten van mijn systematische review?
1. "Wat is het verschil tussen een systematische en een traditionele review?"
Reviews bieden een overzicht van de literatuur. In systematische reviews is het hele proces van vraagstelling tot conclusie transparant. Daarnaast wordt ook de kwaliteit van individuele studies beoordeeld. Dit laat de lezer toe om zelfstandig te beslissen hoeveel vertrouwen hij heeft in de gemaakte conclusies. In traditionele reviews zijn de gebruikte methoden doorgaans niet transparant. Het is bijvoorbeeld niet duidelijk of alle relevante studies werden opgenomen in de review en hoe de conclusies gemaakt werden. Waarom publiceren we zo’n traditionele reviews eigenlijk nog?
Zie ook: https://www.cochrane.org/what-is-cochrane-evidence
2. "Wat zijn Cochrane Systematische Reviews?"
Cochrane reviews zijn literatuuroverzichten over een specifieke onderzoeksvraag, die betrouwbaar zijn. Dat is zo omdat ze gemaakt zijn volgens de hoogst beschikbare standaarden in het veld van systematische reviews. Cochrane is een non-profit organisatie die drijft op het enthousiasme van vrijwilligers over de hele wereld. Hun doel is ervoor zorgen van patiënten, zorgverleners en beleidsmakers, zodat zij hun besluitvorming kunnen baseren op goede informatie. Dit is informatie die gebaseerd is op wetenschappelijke studies (en systematische reviews) eerder dan de persoonlijke overtuigingen van de dokter, de media of eender wie.
Zie ook: https://www.youtube.com/watch?v=AhtchOL1ofc
3. “Wat is het verschil tussen een systematische review en een meta-analyse?”
Deze termen worden soms als synoniemen gebruikt, maar dit is niet correct. Een systematische reviews wijst op de methode van een literatuuroverzicht, dus op het systematisch zoeken en selecteren van studies, de kwaliteitsbeoordeling van individuele studies en een transparante weergave van de resultaten. Een meta-analyse is een statistische methode om de resultaten van individuele studies te combineren. Het geeft een soort gemiddelde waarde over meerdere studies heen. Het is mogelijk om een systematische review met een meta-analyse te doen. Een meta-analyse doen zonder een systematische review heeft doorgaans niet veel zin.
4. “Hoe weet ik of een systematische review van goede kwaliteit is?”
Er bestaat een checklist met 11 items die de kwaliteit van een systematische review omvatten, de AMSTAR (A MeaSurement Tool to Assess systematic Reviews). De verschillende items beoordelen hoe een systematische review werd uitgevoerd, bijvoorbeeld of de onderzoekers vooraf een protocol opstelden, hoe breed hun zoektocht naar relevante literatuur was, of de screening van studies door twee reviewers onafhankelijk van mekaar gebeurde etc. Een systematische review is van goede kwaliteit wanneer aan alle items voldaan werd. De AMSTAR tool kan ook gebruikt worden als hulp-middel bij het uitvoeren van een systematische review.
AMSTAR checklist: www.amstar.ca

5. “Wat is publicatie bias?"
Publicatie bias is een verstoring van de resultaten van een systematische review doordat niet alle studies opgenomen werden. We weten dat studies die negatieve resultaten bevatten, dus studies die aantonen dat een bepaalde behandeling niet werkt, minder kans hebben om gepubliceerd te worden. Zulke studies zijn dus moeilijker om te vinden en om op te nemen in een systematische review. Wanneer een aantal negatieve studies ontbreken in een systematische review zal het resultaat niet representatief zijn voor het ware effect van de onderzochte interventie. Dit is de belangrijkste zwakte van systematische reviews.
Zie ook: https://www.youtube.com/watch?v=UUk0zas0VL4
6. “Hoe omgaan met publicatie bias in een systematische review?”
De methoden van je review moeten proberen om publicatie bias zoveel mogelijk te vermijden, door bijvoorbeeld een heel uitgebreide zoektocht te ondernemen. Verschillende bronnen raadplegen is belangrijk, onder registers van klinische studies. Wanneer je de resultaten van je systematische review interpreteert is het belangrijk dat er studies werden gemist interpreteert. Wanneer de kans op publicatie bias groot is, is het belangrijk dat je het vertrouwen in de resultaten verminderd.
De GRADE working group heeft een systeem ontwikkeld om deze vorm van bias, naast andere vormen van bias, te beoordelen op een systematische manier.
Zie ook:
De kwaliteit van bewijs beoordelen: http://www.jclinepi.com/article/S0895-4356(11)00181-8/fulltext
7. "Is het een goed idee om een systematische review te doen als deel van een doctoraatsthesis?"
Zeker en vast!
Meer en meer financiers vereisen dat onderzoeksvoorstellen ook een systematische review bevatten. En hier is een goede reden voor. Systematische reviews geven een overzicht van wat er al geweten is, waar de gaten in de kennis zitten en wat de mogelijke valkuilen zijn in eerdere studies. Daarom zijn systematische review een ideale start voor elk doctoraat.
8. "Wat is heterogeniteit?"
Heterogeniteit betekent variatie of verschillen tussen studies die opgenomen werden in een systematische review. Heterogeniteit is altijd aanwezig, omdat een systematische review meerdere unieke studies bevat. De variatie tussen studies kan liggen aan de karakteristieken van de bestudeerde deelnemers (bv. Een studie die volwassenen onderzocht, terwijl een andere keek naar 65-plussers), behandeling (bv. Een studie diende medicatie toe in tabletvorm terwijl de een andere injecties gebruikte) of uitkomsten (bv. Een studie bestudeerde ongewenste effecten, terwijl de andere ernstige ongewenste effecten als uitkomst had). Dit noemen we klinische heterogeniteit. Verschillen in studieresultaten (bv. Een studie vond positieve effecten, terwijl de andere negatieve effecten vond) noemen we statistische heterogeniteit.
Zie ook: https://www.youtube.com/watch?v=KSKCTXciGjI

9. "Wat kan ik doen aan heterogeniteit?"
In het geval van klinische heterogeniteit, dus wanneer er verschillen zijn tussen studies met betrekking tot de deelnemers, behandelingen of uitkomsten, moet je goed overwegen of een meta-analyse gepast is. Wanneer je verwacht dat verschillen in studie karakteristieken geen invloed zullen hebben op de resultaten is een meta-analyse gepast. In andere gevallen niet. Deze beslissing dient gemaakt te worden door personen met klinische expertise in het onderwerp.
Statistische heterogeniteit moet onderzocht worden. Eerst test je of het aanwezig is of niet. Wanneer dit het geval is moet je testen hoe groot de heterogeniteit is. Wanneer er een grote mate van heterogeniteit is moet dit verder onderzocht worden. De verschillen methoden hiervoor kunnen hier niet besproken worden, maar meer informatie is te vinden in het Cochrane handboek: https://handbook-5-1.cochrane.org/ chapter 9.5 Heterogeneity
10. "Waarom moet ik vooraf een protocol schrijven voor mijn systematische review?"
Het protocol beschrijft de plannen voor je systematische review. Het is belangrijk dat deze vooraf beschreven worden, zodat je geen veranderingen maakt op basis van de resultaten van studie die opgenomen worden in de review. Dit kan de kwaliteit van je review beïnvloeden, omdat het je in een bepaalde richting duwt. Een goede review houdt een open vizier.
11. "Wat is grijze literatuur?"
Grijze literatuur is een term die alle materiaal dat niet in boeken of vakbladen is gepubliceerd omvat. Voorbeelden hiervan zijn doctoraatsthesissen, abstracts van congressen, werkinstrumenten en technische rapporten. Omdat dit soort materialen niet op de conventionele manier gepubliceerd worden, worden ze niet geïndexeerd in grote databases zoals Medline. Daarom is het vinden van grijze literatuur doorgaans moeilijker dan het vinden van gepubliceerde studies.
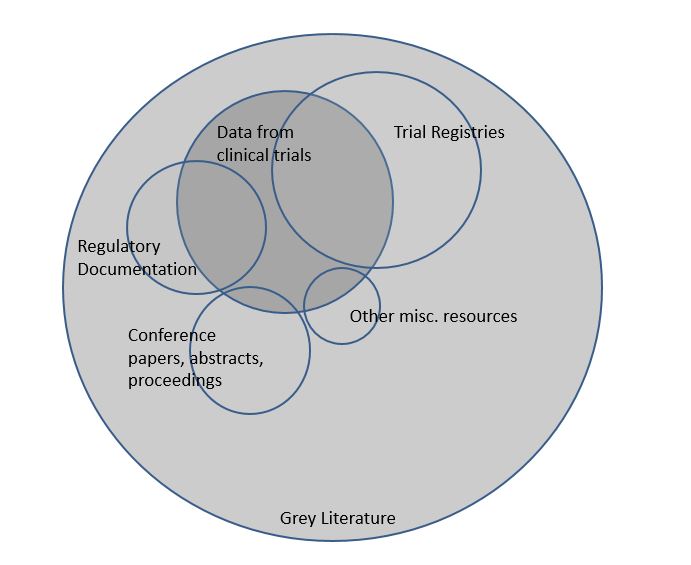
12. "Waarom moet ik grijze literatuur zoeken voor mijn systematische review?"
Cochrane raadt aan om grijze literatuur te doorzoeken, om zo het risico op het missen van studies te verkleinen. Daarnaast is het geweten dat gepubliceerde studies gemiddeld gezien positievere resultaten vertonen dan niet-gepubliceerde studies. Deze studies missen kan dus de resultaten en conclusies van een review beïnvloeden.
Zie ook MECIR standaard C28: https://community.cochrane.org/mecir-manual
13. "Wat is de Cochrane Library?"
Cochrane heeft meerdere bibliotheken ter beschikking om zijn missie, mensen helpen om geïnformeerde beslissingen te maken, te ondersteunen. Er zijn nu 6 bibliotheken met verschillende soorten bewijsmateriaal van hoge kwaliteit. Een hiervan is de Cochrane Database of Systematic Reviews, die alle gefinaliseerde en in ontwikkeling zijnde Cochrane reviews bevat.
De Cochrane Library is beschikbaar via www.thecochranelibrary.com

14. "Wat is Cochrane CENTRAL?"
Cochrane CENTRAL staat voor de Cochrane Register of Controlled Trials, een van de Cochrane bibliotheken. Deze bibliotheek bevat gerandomiseerde en quasi-gerandomiseerde gecontroleerde studies. Cochrane vrijwilligers zoeken in verschillende bronnen naar dit studie type, waarna ze worden opgenomen in CENTRAL. Het is de grootste beschikbare database voor klinische studies, dus als je systematische review dit studie type omvat is zoeken in CENTRAL een goed idee. De database bevat abstracts, maar geen volledige publicaties.
Zie ook: http://www.cochranelibrary.com/about/central-landing-page.html
15. "Welke domeinen zijn geschikt om een systematische review te maken?"
Elk domein is geschikt om een systematische review te maken. Systematische reviews zijn middelen om een vraag te beantwoorden, ongeacht het domein of veld. Voor sommige domeinen is er echte meer expertise beschikbaar over welke de beste methoden zijn om de review uit te voeren. Dat maakt het makkelijker om de review te doen.
16. "Hoe bepaal ik het bereik van mijn review?"
Het bereik van je review kan nauw, breed of iets tussenin zijn. Een voorbeeld van een brede review is “Lichaamsbeweging voor patiënten met hartproblemen”. Deze review kan elk soort lichaamsbeweging en patiënten met verschillende types van hartproblemen bevatten. Bij gevolg zullen de conclusies van deze review erg algemeen zijn.
Nauwe reviews focussen zich op specifieke interventies of populaties, bijvoorbeeld: “Dynamische beenoefeningen in oudere vrouwen die een hartaanval gehad hebben”. Dit soort reviews kan mogelijk erg weinig, of geen studies bevatten. De conclusies van dergelijk review zal erg gedetailleerd zijn; ze zijn enkel van toepassing op een specifieke oefening voor een specifieke patiëntengroep. Meestal zal de klinische relevantie van een onderzoeksvraag het bereik van de review bepalen.
17. "Zijn lege reviews nuttig?"
Lege reviews zijn systematische reviews die geen studies opgenomen hebben. Ze kunnen hun nut hebben om te illustreren dat er geen studies (van goede kwaliteit) beschikbaar zijn om een bepaalde onderzoeksvraag te beantwoorden. Dit kan het uitvoeren van nieuwe studies vergemakkelijken. Anderzijds zijn dit soort studies minder nuttig wanneer de review leeg is omwille van erg strikte selectiecriteria (die niet overeenstemmen met de klinische praktijk).
18. "Wat is een forest plot?"
Een forest plot is een illustratie van een meta-analyse. Het toont de resultaten van zowel elke individuele studie als het gecombineerde resultaat van de meta-analyse. De inschatting en betrouwbaarheidsinterval worden weergegeven voor elke individuele studie. Het gecombineerde resultaat wordt onderaan weergegeven, in de vorm van een diamant. De naam ‘forest plot’ is gebaseerd op het bos van lijnen dat in de figuur weergegeven wordt.
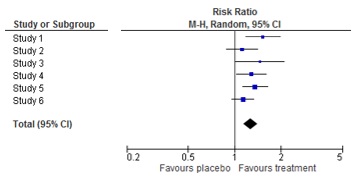
Voor meer informatie over de oorsprong van de forest plot: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1120528/
19. "Het resultaat van mijn meta-analyse is statistisch significant. Wat betekent dit nu?"
Statistische significantie impliceert dat de verschillen tussen twee behandelingen, bijvoorbeeld de resultaten van een meta-analyse, echt zijn en niet gebaseerd op puur toeval of kans. Statistische tests berekenen de kans dat een resultaat gebaseerd is op toeval. Hoe lager deze kans, hoe groter de waarschijnlijkheid dat de resultaten echt zijn. Een verschil wordt statistisch gezien als ‘echt’ beschouwd wanneer de waarschijnlijkheid dat de resultaten gebaseerd zijn op toeval kleiner is dan 5%. Dit is de gekende p-waarde van 0.05.
Statistische significantie betekent niet automatisch dat de resultaten ook klinisch belangrijk zijn.
20. "Wat wordt bedoeld met klinische relevantie?"
Klinische relevantie betekent belangrijk voor de patiënt. Sommige effecten zijn zo klein dat patiënten het verschil niet zouden merken. Om klinische relevantie in te schatten moeten patiënten de grootte van een effect inschatten: is het groot genoeg om van belang te zijn? Er is geen algemene manier om in te schatten of resultaten klinisch relevant zijn. Dit hangt af van de uitkomst, de patiënt en de aandoening.
Om resultaten van een meta-analyse te interpreteren zouden zowel de statistische significantie als de klinische relevantie moeten ingeschat worden.
Meer informatie over statistische significantie versus klinische relevantie: https://www.students4bestevidence.net/statistical-significance-vs-clinical-significance/
21. "Hoe interpreteer je een forest plot?"
Stap 1: Kijk eerst welke groepen of behandelingen met elkaar vergeleken worden.
Stap 2: Kijk naar de uitkomstmaat en hoe het gerapporteerd wordt.
Stap 3: Interpreteer de oriëntatie van de forest plot: welke kan van de plot geeft een voordeel weer voor de behandeling.
Stap 4: Kijk naar de hoeveelheid studies, het aantal patiënten en de significantie van de resultaten in de individuele studies
Met deze informatie kan je een meta-analyse gaan interpreteren. Meer hierover volgende week.
22. "Hoe interpreteer je een meta-analyse?"
Om de resultaten van een meta-analyse te interpreteren bekijk je eerst de richting van het effect: Toont het gecombineerd effect een positief of een negatief effect aan in de interventiegroep, vergeleken met de controlegroep? Daarna bekijk je hoe precies de resultaten van de meta-analyse zijn, via de breedte van het betrouwbaarheidsinterval. Is het effect statistisch significant? Zo ja, is het ook klinisch relevant? Als laatste kijk je of er heterogeniteit tussen de studies aanwezig is.
23. "Wat is de PRISMA checklist?"
PRISMA is een afkorting voor ‘Preferred Reporting Items for Systematic Reviews and Meta-Analyses. Het bevat 27 items die richting geven over hoe het item te rapporteren. PRISMA helpt auteurs van systematische reviews en meta-analyses om hun werk transparant weer te geven. Meer en meer vakbladen vragen auteurs om zich te houden aan deze checklist bij het indienen van een systematische review. Het PRISMA statement verscheen in meerdere vakbladen, bijvoorbeeld:
http://journals.plos.org/plosmedicine/article?id=10.1371/journal.pmed.1000100
24 "Wat is een (PRISMA) flowchart?"
Een flowchart is een diagram dat helpt om de resultaten van een zoektocht naar relevante publicaties op een transparante manier weer te geven. Het geeft aan hoeveel documenten er initieel gevonden werden, hoeveel er uiteindelijk werden opgenomen en alle stadia tussenin. Zo’n flowchart wordt aanbevolen bij de rapportering van een systematische review. Zie ook het PRISMA statement (Nr 23).
25 "Wat is evidence mapping?"
Evidence Mapping is een van de nieuwste types van systematic reviews. Deze reviews proberen ga-ten in onze kennis of nieuwe onderzoeksonderwerpen te identificeren. Typisch aan Evidence Map-ping is een systematische zoektocht van een breed veld. De resultaten worden doorgaans op een gebruiksvriendelijke manier gepresenteerd, met of zonder de visuele hulp van een figuur, grafiek of database. De methodologie van deze reviews staat nog in zijn kinderschoenen.
26 Wat is GRADE?
GRADE komt van ‘Grading of Recommendations Assessment, Development and Evaluation’. Dit is een transparante methode om het vertrouwen in de resultaten van een review te beoordelen en om aanbevelingen in systematische reviews en richtlijnen te formuleren. Veel onderzoekers en internationale organisaties hebben hieraan meegewerkt. GRADE wordt nu beschouwd als gouden standaard om het vertrouwen in wetenschappelijk bewijs over het effect van behandelingen te beoordelen. Een aangepaste GRADE-methodiek is beschikbaar om wetenschappelijk bewijs over diagnostische testen te beoordelen.
Voor meer informatie: http://www.gradeworkinggroup.org/
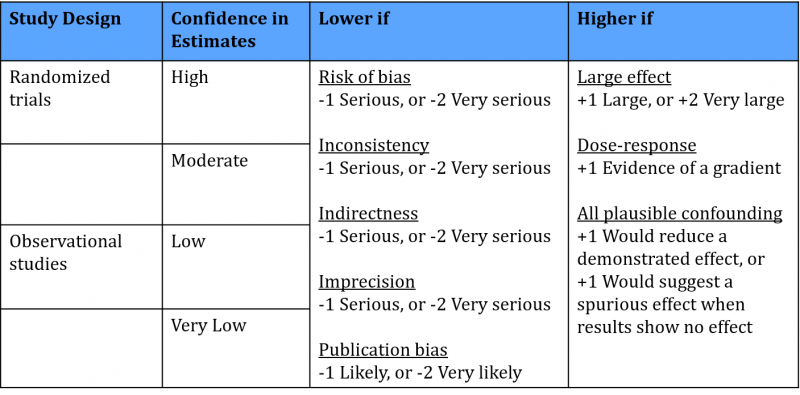
27 Hoe GRADE toepassen, ofwel de kwaliteit van bewijs graderen?
Elke effectmaat van de systematische review ontvangt een beoordeling: hoge, matige, lage of zeer lage kwaliteit. Dit geeft aan hoe zeker we zijn over de resultaten van dit effect. Het GRADE-systeem werkt als volgt:
De beoordeling begint bij het type studie dat in de review is geïncludeerd. Zijn dit RCTs, dan is het begin niveau ‘hoog’. GRADE benoemt vijf factoren die het vertrouwen in de resultaten verlagen, bijvoorbeeld: risico op bias (vertekening van de resultaten) of indirectheid van de resultaten. Elke factor die van toepassing is op de resultaten verlaagt de kwaliteit met 1 niveau; in extreme situaties zelfs met 2 niveaus. Dus, als een van de vijf factoren van toepassing is op de resultaten van de review met RCTs, dan is het eindoordeel ‘matig niveau van kwaliteit’.
Voor systematische reviews van observationele studies is het begin niveau ‘laag’. GRADE benoemt 3 factoren die het vertrouwen in de resultaten verhogen, zoals er is een groot effect of er is bewijs voor een dosis-response relatie. Dus, als een van de drie factoren van toepassing is op de resultaten van de review met observationele studies, dan is het eindoordeel ook ‘matig niveau van kwaliteit’.
Voor meer informatie, lees het online handboek van GRADE: http://gdt.guidelinedevelopment.org/app/handbook/handbook.html
28 Hoe een aanbeveling formuleren met GRADE?
GRADE heeft vier mogelijkheden om aanbevelingen te formuleren: sterk voor, zwak voor, zwak tegen en sterk tegen. Een sterke aanbeveling voor een behandeling betekent dat alle patiënten gebaat zijn met die behandeling, terwijl een zwakke aanbeveling impliceert dat sommige, maar niet alle patiënten de behandeling zouden moeten krijgen.
De aanbeveling weerspiegelt de zekerheid dat deze behandeling meer voordelen dan nadelen heeft. De keuze is dan weer gebaseerd op de afweging tussen effecten en nevenwerkingen, de kwaliteit van het bewijs, de voorkeuren van patiënten en het gebruik van middelen.
Voor meer informatie, lees het online handboek van GRADE: http://gdt.guidelinedevelopment.org/app/handbook/handbook.html
29 Software voor Cochrane reviews– 1. Archie
Archie is een online database voor Cochrane reviewers. Het bewaart alle voorlopige versies van Cochrane reviews. Alle mede-auteurs van een review hebben toegang tot deze database en dus tot de nieuwste versie van de review. Hierdoor kunnen ze efficiënt samenwerken aan dezelfde review. Daarnaast bevat Archie contactgegevens van alle reviewers.
![]()
30 Software voor Cochrane reviews– 2. Review Manager
Review Manager (RevMan) is een programma dat reviewers helpt om een systematische review uit te voeren en te schrijven die voldoet aan de eisen van Cochrane. De software biedt een formaat voor alle stappen van het proces: het formuleren van het protocol, het evalueren van het risico op bias, het uitvoeren van meta-analyses en het schrijven van de review. RevMan ontwerpt ook figuren die de resultaten van de review illustreren.
RevMan was ontwikkeld voor systematische reviews van interventies in de gezondheidszorg. Inmiddels bestaat er ook een versie voor systematische reviews over de betrouwbaarheid van diagnostische testen. Op dit moment werkt Cochrane aan een online versie van RevMan om het programma continue te kunnen updaten en verbeteren.
Meer informatie: https://community.cochrane.org/tools/review-production-tools/revman-5
31. Software voor Cochrane reviews– 3. Covidence
Covidence is ondersteunende software om een review te maken. Het helpt reviewers bij bepaalde stappen van systematische reviews, zoals het screenen van records (op basis van titel en abstract) en het screenen van volledige teksten van records. Dit is niet mogelijk in RevMan. Zowel duplicaat screenen als screeningconflicten oplossen is mogelijk. De software is web-based, dus meerdere auteurs kunnen aan eenzelfde review werken.
Daarnaast ondersteunt de software andere stappen van systematische reviews, zoals het beoordelen van studies op het risico op bias en het coderen van gegevens uit de studies, bijv. studiekenmerken en -uitkomsten. De data en referenties kunnen geëxporteerd worden naar Review Manager.
Meer informatie: https://community.cochrane.org/tools/review-production-tools/covidence
32. Software voor Cochrane reviews – 4. GRADEpro GDT
GRADEpro Guideline Development Tool (GDT) is ondersteunende software voor het samenvatten en presenteren van informatie om medische beslissingen te nemen. Met deze overzichtelijk gepresenteerde samenvatting van informatie kunnen patiënten, clinici en anderen een goed geïnformeerde beslissing nemen voor of tegen een bepaalde gezondheidsinterventie.
Met betrekking tot Cochrane reviews helpt GRADEpro GDT bij het maken van een ‘Summary of Findings’-tabel. Deze tabel geeft voor iedere uitkomst de resultaten in relatieve en absolute cijfers weer, samen met het niveau van kwaliteit. Data van Review Manager kunnen geïmporteerd worden in GRADEpro GDT en omgezet tot een Summary of Findings-tabel, die vervolgens weer kan worden geïmporteerd in Review Manager.
Meer informatie: https://community.cochrane.org/tools/review-production-tools/gradepro-gdt
33 Software voor Cochrane reviews – 5. EPPI-Reviewer
EPPI-Reviewer is ondersteunende software voor alle types systematische reviews. Wat Cochrane reviews betreft, helpt het vooral bij reviews met complexe analyses, inclusief kwalitatieve vergelijkende analyses, en kwalitatieve thematische en framework-syntheses. Cochrane auteurs hebben gratis toegang tot deze software.
De software assisteert bij meerdere stappen van een systematische review, zoals het hanteren van referenties, screenen van studies, gelijktijdige en onafhankelijke dataextractie, kwantitatieve en kwalitatieve analyse en datapresentatie.
Meer informatie: https://community.cochrane.org/tools/review-production-tools/eppi-reviewer
34 Software voor Cochrane reviews – 6. Task Exchange
Task Exchange is geen echte software, maar eerder een platform dat mensen met elkaar in contact brengt.
Het verbindt mensen die hulp nodig hebben met hun systematische review met mensen die anderen willen helpen. Elke taak kan op het platform worden gepost, bijv. hulp met vertaling, beoordeling door patiënten en clinici, gegevensextractie, screening en richtlijnontwikkeling. Wanneer iemand een taak voor je heeft uitgevoerd, kan je een aanbeveling toevoegen.
Meer informatie: https://community.cochrane.org/tools/review-production-tools/taskexchange
35 Wat zijn levende systematische reviews?
Levende systematische reviews zijn een nieuw soort systematische reviews die geüpdatet worden zodra nieuwe studies verschijnen. Het doel is om de systematische reviews actueel te houden, namelijk door de tijd tussen de publicatie van de studies en de opname ervan in systematische reviews te verkorten. Vanzelfsprekend worden nog steeds de beste methoden gebruikt voor het uitvoeren van de review.
Levende systematische reviews zijn vooral relevant voor onderwerpen waar:
- er beduidende onzekerheid over het bewijsmateriaal bestaat;
- binnenkort nieuwe studies over verschijnen, omdat bijv. protocollen van studies al gepubliceerd zijn in trial registers;
- de onderzoeksvraag van belang is voor beleid of praktijk.
Een Cochrane webinar hierover vindt u via deze link: https://training.cochrane.org/resource/introducing-living-systematic-reviews
36 Wat is een funnel plot?
Een funnel plot is een diagram dat wordt gebruikt in meta-analyses ter beoordeling van bias. Het plot toont voor elke studie de effect grootte op één as (bijvoorbeeld de odds ratio) en de grootte van de studie of de precisie ervan op de andere as, meestal uitgedrukt als standaardfout.
Elke stip in de figuur hieronder vertegenwoordigt een studie. Grotere studies hebben kleinere standaardfouten en staan bovenin de figuur. Kleinere studies staan in het midden en de kleinste staan onderaan. Wanneer er geen bias is, wordt de variatie in effecten tussen studies alleen veroorzaakt door verschillen tussen de studie populaties. Omdat deze variatie random is, zijn de effecten van kleinere studies gelijkmatig verdeeld rond de effecten van de grote studies. De stippen vormen dan een piramide of een omgekeerde trechter.
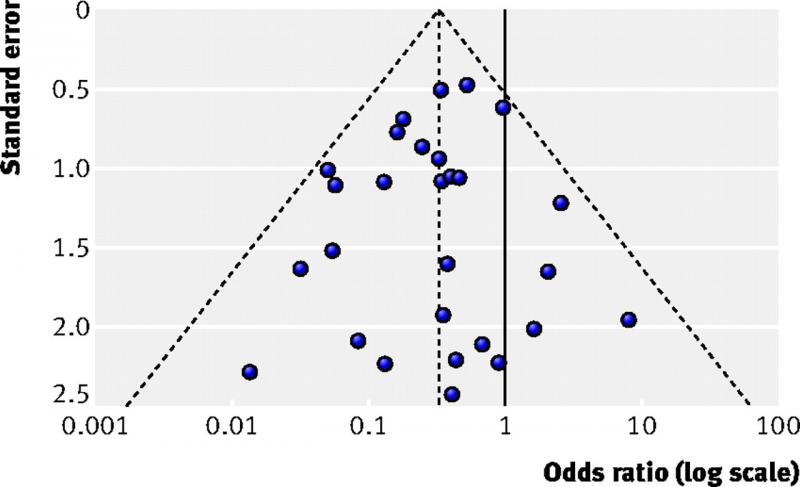
Volgende week beschrijven we hoe een funnel plot te interpreteren.
Meer informatie: Sterne JAC et al. Recommendations for examining and interpreting funnel plot asymmetry in meta-analyses of randomised controlled trials. BMJ 2011;343:d4002
37 Hoe een funnel plot interpreteren?
Asymmetrische funnel plots in systematische reviews van interventiestudies worden soms geïnterpreteerd als de aanwezigheid van publicatiebias. Dit is echter niet altijd waar. Er zijn verschillende verklaringen voor asymmetrische funnel plots, zoals:
• reporting bias, d.w.z. dat significante resultaten die een positief effect suggereren meer kans hebben op publicatie dan niet-significante resultaten;
• echte heterogeniteit, d.w.z. verschillende resultaten tussen subgroepen (zie onderstaande figuur);
• methodologische problemen, die leiden tot inflatie van resultaten van kleine studies;
• toeval, vooral als de systematische review weinig studies bevat.
Naast het maken van een funnel plot zijn statistische tests hiervoor aanbevolen. Deze tests hebben weinig power, wat betekent dat bias niet kan worden uitgesloten als de test negatief is. Enkele algemene aanbevelingen voor het testen op asymmetrische funnel plots:
• Beschrijf in je protocol welke tests op asymmetrische funnel plots je wil doen.
• Voer deze tests enkel uit als je systematische review ten minste 10 studies bevat.
• Interpreteer de resultaten van de tests samen met een visuele inspectie van de plot.
• Beschouw in geval van asymmetrie publicatie bias als een van de mogelijke verklaringen.
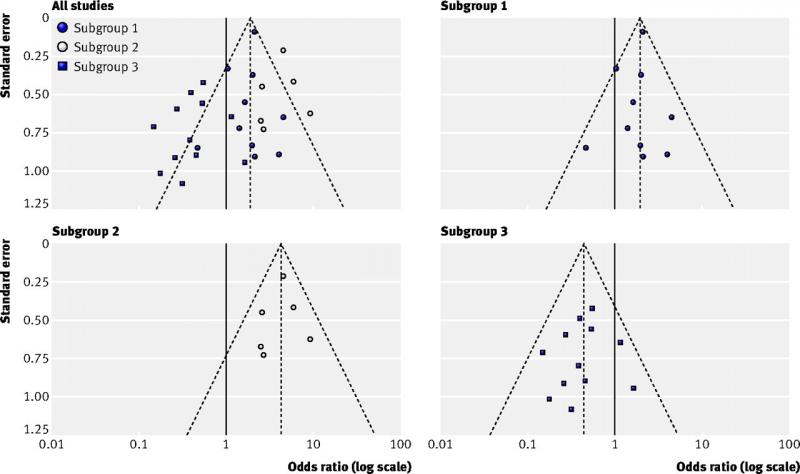
Figuur linksboven (alle studies): asymmetrische funnel plot o.w.v. echte heterogeniteit
Andere figuren (subgroup 1, 2 en 3): resultaten van drie subgroepen die de heterogeniteit verklaren
(Bron: Sterne et al, 2011)
Meer informatie: Sterne JAC et al. Recommendations for examining and interpreting funnel plot asymmetry in meta-analyses of randomised controlled trials. BMJ 2011;343:d4002
Cochrane Handbook for Systematic Reviews of Interventions. Chapter 10.4.1 Funnel plots
38 Wat is een netwerk-meta-analyse?
Netwerk-meta-analyses vergelijken de effecten van verschillende behandelingen voor dezelfde aandoening. Traditionele meta-analyses daarentegen vergelijken slechts twee behandelingen. Netwerk-meta-analyses zijn nuttig om verschillende behandelingen voor een aandoening te evalueren en te achterhalen welke behandeling het meest effectief is.
Hoe werkt het?
Veel studies vergelijken een behandeling enkel met placebo, terwijl andere studies twee behandelingen met elkaar vergelijken. Netwerk-meta-analyses kunnen al het bewijsmateriaal in één analyse bevatten; zowel directe als indirecte bewijzen (zie figuur onder). Direct bewijs komt voort uit studies die behandeling A met behandeling B vergelijken. Voor indirect bewijsmateriaal zijn twee soorten studies nodig: studies die behandeling A met C (bijv. placebo) vergelijken en studies die behandeling B met C vergelijken. Door beide effecten van elkaar af te trekken kan je het effect van A ten opzichte van B schatten. Belangrijk hierbij is dat behandeling C tussen alle studies vergelijkbaar is. Op deze manier wordt een netwerk van effecten tussen alle mogelijke interventies gebouwd met behulp van direct en indirect bewijsmateriaal.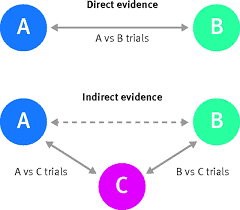
Korte video's over dit onderwerp:
https://training.cochrane.org/resource/introduction-network-meta-analysis-nma
Bron figuren:
BMJ (BMJ 2017;358:j3932)
Cochrane (http://www.cochranelibrary.com/app/content/special-collections/article/?doi=10.1002/(ISSN)14651858(CAT)Freeaccesstoreviews(VI)networkmetaanalysis)
De volgende weken bespreken we de domeinen van de Cochrane ‘risk of bias’ tool. Deze tool is de gouden standaard voor de beoordeling van het risico op bias van gerandomiseerde gecontroleerde studies (RCT) in systematische reviews van interventies.
39 Risico op bias: willekeurige volgorde van toewijzing
RCT’s zijn zeer geschikt om de effecten van interventies te onderzoeken. De randomisatieprocedure zorgt voor gelijke prognostische factoren en dus twee vergelijkbare groepen bij aanvang van de studie.
De eerste stap van een goede randomisatie is het genereren van een willekeurige volgorde. Deze lijst geeft de volgorde aan van toewijzing van de deelnemers. Het belangrijkste principe van een goede randomisatie is dat je onmogelijk kan voorspellen welke behandeling de volgende deelnemer zal ondergaan.
Als je kan voorzien naar welke groep de volgende patiënt zal worden toegewezen, kan risico op bias optreden als gevolg van veranderende selectieprocedures. Patiënten kunnen selectief of helemaal niet worden geïncludeerd als de volgende behandeling niet passend lijkt. Dit verhindert een evenwichtige inclusie en kan tot verschillen tussen beide groepen leiden.
Inadequate manieren van een willekeurige volgorde zijn bijvoorbeeld het toewijzen volgens geboortedatum of dag van de week. Adequate manieren zijn bijvoorbeeld lijsten met willekeurige getallen of een computergegenereerde lijst met willekeurige getallen.
40 Risico op bias: verbergen van de toewijzing
De tweede stap van een goede randomisatie is het verbergen van de toewijzingsvolgorde voor de mensen die betrokken zijn bij de studie. Dit betekent dat de deelnemers en onderzoekers niet weten welke behandeling de volgende deelnemer zal ontvangen.
Als je kan voorzien naar welke groep de volgende patiënt zal worden toegewezen, kan risico op bias optreden als gevolg van veranderende selectieprocedures. Patiënten kunnen selectief of helemaal niet worden geïncludeerd als de volgende behandeling niet geschikt lijkt. Dit verhindert een evenwichtige inclusie en kan tot verschillen tussen beide groepen leiden.
Een adequate manier is bijv. een centrale toewijzing, waarbij de persoon die de deelnemer rekruteerde een onafhankelijk centrum of persoon contacteert die de volgende toewijzing doorgeeft. Dit kan telefonisch gebeuren, via internet of bij een apotheker.
Een inadequate manier is bijv. het gebruik van enveloppen die onvoldoende beveiligd zijn, bijv. niet dichtgeplakt, doorschijnend of niet opeenvolgend genummerd.
41 Risico op bias: blindering patiënten en personeel
Verschillende (groepen) personen kunnen geblindeerd worden in een gerandomiseerde gecontroleerde studie. Dit domein richt zich op het blinderen van patiënten en zorgverleners.
Gebrek aan blindering kan een invloed hebben op de uitkomsten van de deelnemers van de studie, bijv. omdat personen in de controlegroep lagere verwachtingen hebben. Er kunnen systematische verschillen tussen groepen optreden, bijv. in de dropout, co-interventies of follow-up-procedures. Effectieve blindering zorgt ervoor dat de twee groepen een soortgelijke hoeveelheid aandacht, ondersteunende behandeling en diagnostische onderzoeken krijgen.
Het risico op bias kan hoog zijn voor sommige uitkomsten en laag voor andere. Gebrek aan blindering kan bijv. een invloed hebben op de levenskwaliteit, maar minder op mortaliteit. Het risico op bias door gebrek aan blindering moet daarom afzonderlijk beoordeeld worden voor verschillende uitkomstmaten.
42 Risico op bias: blindering van beoordelaars
Blindering van de beoordelaars is een afzonderlijk domein in het risico op bias instrument van Cochrane. Deze beoordelaars voeren de beginmetingen uit en meten de resultaten van studies. Als zij weten welke behandeling een bepaalde deelnemer ontvangt, kan dit hun oordeel beïnvloeden. Dit risico op bias is vooral, maar niet uitsluitend, van belang voor subjectieve uitkomstmaten zoals het stellen van een diagnose op basis van röntgenfoto's en scans.
43 Risico op bias: onvolledige uitkomstdata
De term ‘onvolledige uitkomstdata’ verwijst naar het ontbreken van gegevens in een studie doordat patiënten uitvallen, afhaken of uitgesloten worden nadat ze gerandomiseerd werden. Sommige uitsluiting kunnen gerechtvaardigd zijn, bijv. patiënten die verhuizen, maar dergelijke uitsluitingen moeten plaatsvinden voordat alle resultaten worden gemeten.
Het risico op bias gerelateerd aan onvolledige uitkomstdata hangt af van verschillende factoren, waaronder de volgende:
- Van hoeveel patiënten ontbreken de gegevens?
- Zijn deze aantallen in evenwicht tussen de groepen?
- Wat zijn de redenen voor dropout?
- Zijn de resultaten tussen patiënten met of zonder gegevens verschillend?
- Hoe moeten de ontbrekende resultaten geïnterpreteerd worden in een klinische context?
Het risico op bias is laag als de redenen voor het ontbreken van gegevens in voldoende detail worden beschreven en als ze gelijk verdeeld zijn over de groepen. Als de redenen voor dropout alleen in algemene termen worden beschreven, is het moeilijk om de gevolgen ervan te beoordelen. 'Weigeren patiënten deelname' omdat ze niet willen oefenen in de experimentele groep, of omdat ze ontevreden zijn met het advies om niet te oefenen in de controlegroep?
De stelling 'wij voerden een ITT-analyse uit' is een onvoldoende basis om een laag risico op bias te verwachten, omdat de term ITT geen consistente definitie heeft. Een echte ITT volgt 3 principes:
- Houd deelnemers in de groepen waartoe ze werden gerandomiseerd, ongeacht de interventie die ze daadwerkelijk ontvangen.
- Meet uitkomstdata van alle deelnemers.
- Neem alle gerandomiseerde deelnemers op in de analyse.
Het risico op bias is hoog als de dropout gekoppeld is aan de studieresultaten, bijv. als ziekere mensen een hogere kans hebben op dropout. Het uitsluiten van patiënten omwille van het 'falen van een behandeling' kan bias opleveren als de aantallen voor de behandelgroepen niet gelijk zijn.
Zie Cochrane Handbook sectie 8.13 voor meer informatie (https://handbook-5-1.cochrane.org/)
44 Risico op bias: selectieve rapportage
'Selectieve rapportage' verwijst naar de situatie waarin niet alle variabelen uit een studie worden gerapporteerd. Dit is een potentiële bron van bias, omdat het meestal niet-significante resultaten betreft. Meta-analyses die geen niet-gepubliceerde resultaten bevatten, overschatten dus waarschijnlijk het effect van interventies.
De volgende situaties zijn voorbeelden van selectieve rapportage. Er kan risico op bias optreden wanneer de niet-significante resultaten selectief worden weggelaten.
- selectieve rapportage van uitkomsten binnen een studie;
- selectieve keuze van gegevens voor een uitkomst:
- Sommige resultaten worden gerapporteerd m.b.v. verschillende maten, of worden op verschillende tijdstippen gemeten.
- selectieve rapportage van analyses van dezelfde gegevens:
- Er zijn verschillende manieren om gegevens te analyseren, bijv. de eindscore of het verschil ten opzichte van de beginmeting.
- Continue gegevens, bijv. een VAS pijnschaal, kunnen worden beschreven als gemiddelde of als drempelwaarde (het aantal personen met een pijnscore van minstens 6).
- selectieve rapportage van subsets van gegevens:
- Sommige uitkomstmaten, bijv. de levenskwaliteitsschaal SF-36, geven een totaalscore, maar ook scores van verschillende subschalen.
- selectieve onderrapportage van resultaten, zodanig dat ze niet bruikbaar zijn voor een meta-analyse:
- Sommige artikels stellen dat "de resultaten niet significant waren".
Om een eventueel risico op bias te bepalen, moeten review auteurs op zoek gaan naar het protocol van de review en dit vergelijken met de volledige review.
45 Risico op bias: andere bronnen
Het Cochrane-instrument ter beoordeling van het risico op bias heeft de mogelijkheid om “andere bronnen van bias” te rapporteren. Eerdere versies van het Cochrane handboek beschreven het vroegtijdig stoppen van een studie als voorbeeld van een bron van bias. Nieuw bewijs geeft echter aan dat een studie vroegtijdig stoppen niet noodzakelijk leidt tot bias.
De herziene versie van het Cochrane handboek adviseert dit domein alleen te gebruiken voor uitzonderlijke gevallen. Wordt het gebruikt, dan moet het item betrekking hebben op een probleem dat rechtstreeks leidt tot bias. Zo kan een studie andere problemen vertonen m.b.t. de opzet die een bias kunnen veroorzaken.
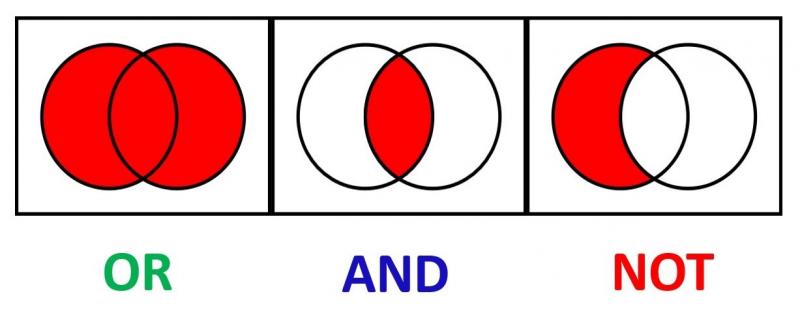
46. Wat zijn booleaanse operatoren?
Booleaanse operatoren zijn woorden die kunnen worden gebruikt voor het opstellen van een (systematische) zoekstrategie. Deze woorden verbinden meerdere zoektermen met de bedoeling specifiekere of bredere resultaten te vinden. De meest bekende zijn de woorden ‘AND’, ‘OR’ en ‘NOT’.
De zoekvraag “lichaamsbeweging ‘OR’ knieartrose” resulteert in items die de termen lichaamsbeweging of knieartrose bevatten, en genereert dus bredere resultaten.
De zoekvraag “lichaamsbeweging ‘AND’ knieartrose” resulteert in items die zowel de term “lichaamsbeweging” als “knieartrose” bevatten, en genereert dus meer specifieke resultaten.
De zoekvraag “lichaamsbeweging ‘NOT’ knieartrose” excludeert de items over knieartrose. Deze zoekvraag resulteert in items over lichaamsbeweging, maar niet over knieartrose.
47 Wat zijn proximity-operatoren?
Proximity-operatoren zijn termen waarmee je kunt zoeken naar twee te combineren woorden met de bedoeling meer specifieke resultaten te bekomen. Elke databank heeft haar eigen proximity-operatoren. Hieronder enkele voorbeelden van de Cochrane databank.
De term ‘near’: zoeken met bv. ‘prostate near cancer’ geeft alle reviews weer die ‘prostate’ en ‘cancer’ bevatten met maximaal 6 woorden ertussen. De volgorde van de woorden maakt niet uit. Zo kom je zowel op ‘cancer of the prostate’ als op ‘prostate and bowel cancer’. Het is mogelijk om het aantal woorden ertussen te bepalen door ‘near/x’ te gebruiken waarbij x staat voor het aantal woorden.
Met de term ‘next’ vind je reviews die het eerste woord vóór hettweede gebruiken. Zo geeft zoeken met ‘prostate next cancer’ alleen de reviews weer waar ‘prostate’ vóór ‘cancer’ staat.
Pubmed heeft geen proximity-operatoren.
48 Wat zijn indextermen?
Indextermen zijn gestandaardiseerde termen die databanken toewijzen aan nieuwe artikels. Veel databanken, zoals MEDLINE, Cochrane en Embase, kun je doorzoeken met indextermen. MeSH-termen, ofwel ‘Medical Subject Headings’, zijn de meest bekende. Deze worden gebruikt in MEDLINE en Cochrane. In Embase worden Emtree-termen gebruikt.
Indextermen zijn handig als je op zoekt bent naar studies voor een systematische review, omdat je er artikels mee kan vinden die andere termen gebruiken om hetzelfde onderwerp te beschrijven.
Een zoekstrategie die alleen uit indextermen bestaat, zal waarschijnlijk niet alle relevante artikels vinden, omdat de manier van toewijzen van indextermen tussen de databasen niet gestandaardiseerd is. Bovendien hebben de meest recente artikels mogelijk nog geen indextermen.
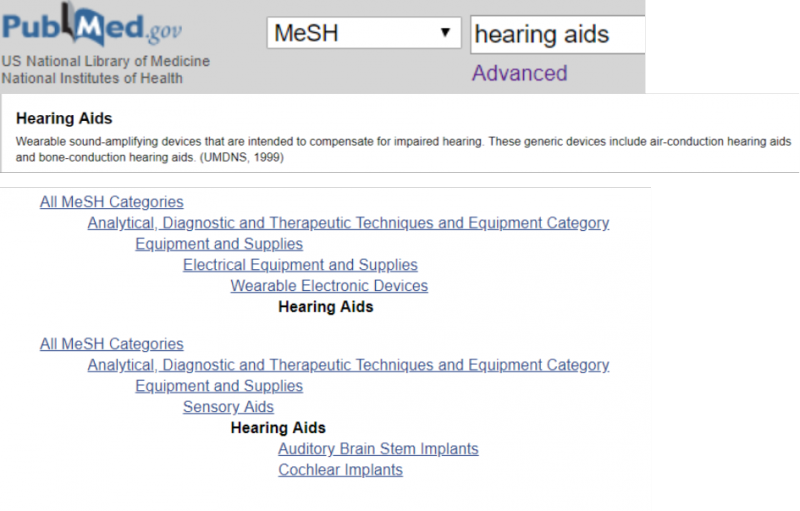
49 Wanneer gebruik je publicatietype-termen in je zoekstrategie?
Publicatietype is een van de verschillende categorieën van de MeSH-databank. Met deze termen kun je een onderscheid maken tussen artikels van, bijvoorbeeld, gerandomiseerde studies en artikels over gerandomiseerde studies. Een artikel dat resultaten van een gerandomiseerde gecontroleerde studie beschrijft, krijgt een publicatietype-indexterm ‘Randomized Controlled Trial’. Artikels over gerandomiseerde gecontroleerde studies krijgen de MeSH-indexterm ’Randomized Controlled Trials as Topic’. Dit principe geldt ook voor indextermen voor andere studietypes.
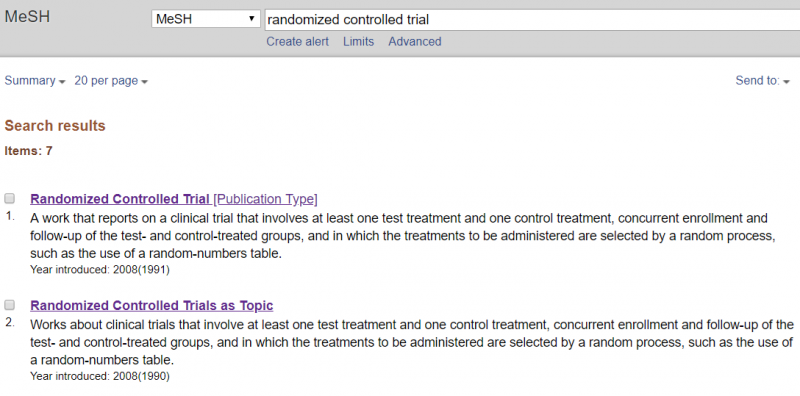
50. Hoe kun je het risico op bias in de zoekactie minimaliseren?
Systematische reviews vereisen een uitgebreide zoekactie om zo veel mogelijk relevante studies te vinden. Dit vermindert ook het risico op selectiebias in de getraceerde studies. De uitgebreide zoekactie is een van de kenmerken die systematische reviews van narratieve reviews onderscheidt en de kans op betrouwbare resultaten verhoogt.
Om het risico op bias in de zoekactie te minimaliseren, beveelt Cochrane aan om meerdere databanken te doorzoeken; ten minste Cochrane’s centrale register van gecontroleerde studies (CENTRAL), aangevuld met Medline en Embase (indien niet reeds gedekt door het bovengenoemde register). Cochrane raadt verder aan om trial registers te doorzoeken en referentielijsten van relevante studies en systematische reviews te screenen. Bovendien kan het nuttig zijn om, afhankelijk van het onderwerp en de mogelijkheden, grijze literatuur te zoeken, contact op te nemen met andere onderzoekers, andere databanken te doorzoeken (nationale, regionale of databanken voor specifieke onderwerpen) of referentielijsten van reviews over verwante onderwerpen te screenen.
Zie ook Methodological Expectations of Cochrane Reviews of Interventions (MECIR) standaarden (standaard C24-32): MECIR handleiding
51. Wat zijn citatie-indexen?
Citatie-indexen zijn databanken van gepubliceerde artikels met links naar andere artikels die deze eerste citeren. Voorbeelden zijn Web of Science, Scopus en Google Scholar.
Bij het maken van een systematische review kun je citatie-indexen doorzoeken als een brondatabank. Daarnaast kun je via de links nieuwe potentieel relevante studies vinden op 2 manieren. Hiervoor start je met een studie die al geïncludeerd is in je systematische review. Met behulp van de citatie-indexen kun je enerzijds (oudere) studies bekijken die in je geïncludeerde studie geciteerd worden en anderzijds (recentere) studies die je geïncludeerde studie zelf citeren. Het nagaan van citaties is een bruikbare zoekstrategie, aanvullend op het doorzoeken van literatuurdatabanken.
52. Wat is Scopus en Web of Science?
Scopus is een citatiedatabank (zie EHSR van vorige week). Deze bevat zowel abstracts van studies als citaties van en naar andere artikels. Scopus richt zich vooral op sociale geneeskunde, maar bevat ook artikels over geneeskunde.
Web of Science is de internetdatabank van Science Citation Index, vroeger gekend als ‘Web of Knowlegde’. Deze collectie van wetenschappelijke databanken richt zich vooral op hoge-impact- en Engelstalige literatuur over wetenschap en technologie.
Een andere citatiedatabank, Google Scholar, is sterk in soorten informatie die niet uit tijdschriften komen.
Verschillen tussen de databanken zijn bijvoorbeeld gerelateerd aan de hoeveelheid disciplines, internationale en niet-Engelstalige studies en andere soorten informatie die ze omvatten, zoals rapporten en doctoraatsthesissen. De bibliotheek van de Universiteit van Iowa State heeft de drie databanken met elkaar vergeleken: https://bit.ly/2wwiuP3
Welke databank moet je nu doorzoeken voor je systematische review? Op deze vraag bestaat geen simpel antwoord. Het hangt van je onderwerp af. Probeer ze best allemaal uit en bekijk het resultaat.
53 Wat is het verschil tussen Medline/PubMed en Embase?
Medline is een databank met biomedische en levenswetenschappelijke tijdschriften, uitgebracht door de Amerikaanse Medische Bibliotheek. De databank richt zich vooral op professionals in de gezondheidszorg, inclusief onderzoekers, zorgverleners, docenten, administratieve krachten en studenten. PubMed is de zoekmachine voor Medline en is gratis toegankelijk. Voor OVID, de andere zoekmachine voor Medline, heb je een abonnement nodig.
Embase is een Europese databank van biomedische tijdschriften en conferentie-abstracts, uitgebracht door Elsevier. Het richt zich sterk op farmacologie, met tijdschriften over geneesmiddelenonderzoek (van de ontwikkeling tot tests en verkoop ervan) en toxicologie. Het indexsysteem van Embase, EMTREE, is ook gevoeliger om artikels over farmacologische onderwerpen te vinden.
54 Wat zijn Cinahl, PsycINFO en PsycNet?
Cinahl en PsycINFO zijn onderwerpspecifieke tijdschriftdatabanken. Om deze databanken te doorzoeken, heb je een abonnement nodig.
Cinahl is sterk gericht op verpleegkundige onderwerpen en andere paramedische onderwerpen zoals kinesitherapie, ergotherapie, logopedie, voeding en diëtetiek.
PsycINFO focust eerder op psychologische onderwerpen, en specifiek op gedragswetenschappen en sociale wetenschappen. PsycNet is het platform dat toelaat om PsycINFO te doorzoeken, en is ontwikkeld door de American Psychological Association (APA). Het bevat ook andere informatiebronnen zoals boeken en video’s.
55 Waarom doorzoek ik best meerdere databanken?
Om de kwaliteit van je systematische review te verhogen, doorzoek je best meerdere databanken. Zoals beschreven in de voorgaande EHSR’s, zijn er verschillen tussen databanken, bijvoorbeeld in de onderwerpen en dus tijdschriften en eventuele andere bronnen die ze bevatten, en in de manier van indexeren en citeren van hun artikels. Zoeken in verschillende databanken verhoogt de kans om meer relevante studies te vinden.
Het belang hiervan wordt verduidelijkt door de zogenaamde MECIR standaarden over hoe je een Cochrane review schrijft. Ze zeggen dat “het zoeken naar studies zo uitgebreid mogelijk zou moeten zijn om het risico op publicatiebias te verminderen en om zoveel mogelijk relevant bewijsmateriaal te vinden“.
56 Andere suggesties om de kwaliteit van mijn zoekstrategie te verbeteren?
Het is niet nodig om de zoekstrategie door twee verschillende personen te laten uitvoeren. Zo’n duplicatie wordt wel aanbevolen voor andere stappen, zoals het screenen van studies voor inclusie of het beoordelen van het risico op bias.
Wel is het nuttig om een bibliothecaris of informatiespecialist met ervaring in systematische reviews te vragen om jouw zoekstrategie te peer reviewen. Peer review kan fouten in de zoekstrategie opsporen. De bibliothecaris kan ook suggesties formuleren voor de selectie van zoektermen, wat extra records kan opleveren. Het PRESS (Peer Review of Electronic Search Strategies) statement geeft hier richtlijnen voor. Voor meer informatie: PRESS statement

57 Wat is nieuw aan de Cochrane risk of bias tool 2?
Cochrane heeft het instrument voor de beoordeling van het risico op bias van RCT’s herzien. Een geüpdatete versie, RoB tool 2, is nu beschikbaar. Vandaag beschrijven we 5 vernieuwingen van het instrument, die we in de komende 5 weken in meer detail zullen toelichten.
De RoB 2 tool:
1. beoordeelt het risico op bias van afzonderlijke resultaten, in plaats van het risico op bias van een studie als geheel;
2. bestaat uit 5 domeinen, die de belangrijkste bronnen van bias omvatten. Het is niet mogelijk om nieuwe domeinen van bias toe te voegen;
3. hanteert signaleringsvragen om het gebruik van het instrument eenvoudiger en transparanter te maken;
4. heeft de antwoordmogelijkheden aangepast naar ‘ja’, ‘waarschijnlijk wel’, ‘waarschijnlijk niet’, ‘nee’ en ‘geen informatie’. Het is niet meer mogelijk om bij items 'onduidelijk' te antwoorden;
5. maakt gebruik van een formeel algemeen risico op bias-oordeel.
Bruikbare webinars vind je hier: risk of bias 2
Meer informatie over het instrument: riskofbias.info
58 Cochrane risk of bias 2 tool beoordeelt bias in resultaten in plaats van studies
Het herziene Cochrane risk of bias instrument richt zich op resultaten van studies die het effect van twee interventies op een bepaalde uitkomst vergelijken. Omdat studies meestal meerdere resultaten beschrijven, moeten meerdere risk of bias evaluaties uitgevoerd worden voor 1 studie. Op dit moment zijn er nog geen aanbevelingen over het aantal uit te voeren beoordelingen per studie. Een goede indicatie hiervoor is het beoordelen van de resultaten beschreven in de Summary of Findings tabel.
59 Cochrane risk of bias 2 tool gebruikt signaliseringsvragen
Het nieuwe instrument heeft vijf domeinen waarbinnen risico op bias voor een studieresultaat kan voorkomen. Voor elk domein bevat het instrument vragen om dit risico te beoordelen. Deze vragen gaan na of de studie al dan niet belangrijke criteria volgt om bias te voorkomen. Een voorbeeld: 'Was de volgorde van toewijzing willekeurig'? Signaliseringsvragen zijn bedoeld om het gebruik van dit instrument eenvoudiger en transparanter te maken.
Elke vraag kan de onderzoeker beantwoorden met ‘ja’, ‘waarschijnlijk wel’, ‘waarschijnlijk niet’, ‘nee’ of ‘geen informatie’. Als het antwoord duidelijk is, zal hij ‘ja’ of ‘nee’ kiezen. In andere gevallen, waar de onderzoeker een oordeel moet maken, zal hij kiezen voor ‘waarschijnlijk wel’ of ‘waarschijnlijk niet’.
Het nieuwe instrument bevat algoritmen die leiden tot een algemene beoordeling van het risico op bias in een domein.
60 Cochrane risk of bias 2 tool heeft geen optie ‘onduidelijk’ meer
Waar mogelijk beantwoordt men de signaleringsvragen van het nieuwe instrument met ‘ja’, ‘nee’, ‘waarschijnlijk wel’ of ‘waarschijnlijk niet’. In tegenstelling tot de eerste versie van het instrument is er geen mogelijkheid meer om ‘onduidelijk’ te scoren. Als een studie onvoldoende details verstrekt die nodig zijn om een beoordeling te maken, is er de optie ‘geen informatie’.
In sommige gevallen kan men, zelfs als informatie ontbreekt, toch een redelijk oordeel vellen. Als bijvoorbeeld informatie over de randomisatiemethode ontbreekt voor een grote gerandomiseerde trial, dan is het antwoord 'waarschijnlijk wel' op de vraag of de toewijzing geblindeerd was waarschijnlijk accurater dan ‘geen informatie’.
61 Cochrane risk of bias tool 2. Domein 1: bias voortkomend uit het randomisatieproces
Het proces van randomisatie is belangrijk, omdat dit ervoor zorgt dat de twee groepen bij aanvang van een studie vergelijkbaar zijn. Er zijn 3 signaleringsvragen voor dit domein:
1. Was de volgorde van toewijzing willekeurig?
2. Was de volgorde van toewijzing verborgen totdat de deelnemers waren ingeschreven en aan groepen toegewezen?
3. Wezen verschillen tussen groepen bij aanvang van de studie op een probleem met het randomisatieproces?
De nieuwe tool suggereert een algoritme om het risico op bias voortkomend uit het randomisatieproces te kunnen beoordelen.
Bron: riskofbias.org
62 Cochrane risk of bias tool 2. Domein 2: bias door afwijking van de geplande interventies
Afwijking van geplande interventies kan bepalend zijn, omdat dit kan leiden tot een systematisch verschil tussen de effectief verleende zorg en de geplande zorg (zoals beschreven in het protocol).
De beoordeling voor dit domein hangt af van het doel van de review. Dit kan het kwantificeren van het intention-to-treat effect zijn (het effect van het toewijzen aan een interventie), of het per-protocol effect (het effect van het uitvoeren van een interventie).
Signaliseringsvragen voor dit domein peilen of de deelnemers en de personen die de interventie verstrekken geblindeerd waren en of de auteurs van de studie hun resultaten correct hebben geanalyseerd. Een laag risico op bias voor dit domein geldt alleen als beide onderdelen correct zijn uitgevoerd. Als de deelnemers en personen die de interventie verlenen niet geblindeerd zijn, is een meer gedetailleerde evaluatie nodig van de mogelijke afwijking.
Bron: riskofbias.org
63 Cochrane risk of bias tool 2. Domein 3: bias door ontbrekende gegevens
Het ontbreken van gegevens is belangrijk, omdat het resulteert in analyses die niet alle deelnemers bevatten. Dit leidt tot bias als er een link is tussen de oorzaak van het ontbreken van de gegevens en de werkelijke waarde van de uitkomst.
Je kunt er enkel zeker van zijn dat er geen bias is als de uitkomsten zijn gemeten bij alle deelnemers of als er zo weinig gegevens ontbreken dat de impact te klein is om belangrijk te kunnen zijn. In alle andere situaties moet je de oorzaken van het ontbreken van de gegevens en de impact ervan beoordelen.
Items voor het beoordelen van dit domein zijn:
• Hoeveel gegevens ontbreken in elke groep?
• Is er enig bewijs dat het eindresultaat niet vertekend is?
• Kunnen de ontbrekende gegevens gelinkt zijn aan de werkelijke waarde van de uitkomst?
In tegenstelling tot de vorige risico-op-bias tool beoordeelt dit domein niet de deelnemers die uit de analyses werden gesloten. Dit valt nu onder het domein 'bias door afwijkingen van geplande interventies'.
Bron: riskofbias.org
64 Cochrane risk of bias tool 2. Domein 4: bias door fouten in de meting van de uitkomsten
Fouten in de uitkomstmeting hebben een impact op de effectschatting van de interventie. Dergelijke fouten leiden vaker tot bias als er een systematisch verschil is in de wijze van uitkomstmeting tussen de interventie- en de controlegroep. Het blinderen van de personen die de uitkomsten meten vermindert het risico op zulke fouten.
Dit domein beoordeelt de wijze waarop de resultaten worden gemeten:
1. RCT’s moeten gebruik maken van de juiste uitkomstmaten. Het gaat niet om de keuze van de uitkomstmaat, maar om de betrouwbaarheid en geldigheid van de meting ervan.
2. De resultaten moeten op dezelfde manier worden gemeten in de twee groepen.
3. Het is belangrijk om weten of de persoon die de uitkomst mat, geblindeerd was (niet op de hoogte van de interventie). Als dit niet het geval was en de interventie dus gekend was, beoordeelt dit domein of de meting hierdoor kan worden beïnvloed, en hoe waarschijnlijk deze beïnvloeding is.
Bron: riskofbias.org
65 Cochrane risk of bias tool 2. Domein 5: bias door selectie van het gerapporteerde resultaat
Een belangrijke verandering van de nieuwe tool is dat deze zich richt op risico op bias voor een gerapporteerd resultaat. Dit vijfde domein beoordeelt of dit resultaat is gekozen uit meerdere gemeten en geanalyseerde resultaten. Dit kan tot bias leiden als de selectie gebeurde op basis van de richting, omvang of significantie van het resultaat. Het domein omvat niet de bias als gevolg van onvolledige verslaglegging; in dit geval worden resultaten voor een specifieke uitkomst helemaal niet beschreven, ook niet als dit selectief gebeurde.
Signaleringsvragen gaan na of het resultaat werd geselecteerd uit meerdere metingen van de uitkomstmaat (zoals pijn gemeten met behulp van VAS en de McGill pijn-vragenlijst), op meerdere tijdstippen of meerdere analyses van de gegevens (zoals niet-gecorrigeerde vs. gecorrigeerde resultaten, eindwaarde vs. verschil van een waarde ten opzichte van baseline).
66 Hoe ziet een goed studieselectie-formulier eruit?
Een goed studieselectie-formulier beschrijft de criteria voor alle belangrijke elementen van de onderzoeksvraag. Deze criteria helpen reviewers bepalen of een studie wel of niet in de review wordt opgenomen. Belangrijke elementen voor reviews van behandelingen zijn een beschrijving van:
1) de populatie;
2) de interventie;
3) de controle.
De checklist beschrijft elk criterium duidelijk en expliciet, en helpt zo twee onafhankelijke reviewers om eenzelfde beslissing te nemen over een potentieel relevante studie. Deze checklist is onderdeel van het protocol en moet klaar zijn voor de start van de review. De checklist meldt ook of de uitkomstmaten al dan niet onderdeel zijn van het selectieproces, omdat dit niet altijd het geval is. Zie ook MECIR-criteria: C5-13 (https://bit.ly/2RcIRBW).

67 Moeten we echt in parallel werken om een goede systematische review te maken, en in welke stappen van de review is dit het belangrijkst?
Het voorbereiden en uitvoeren van een systematische review vraagt veel beslissingen. Het in parallel en apart laten schrijven van delen van een review door twee personen, vermindert de kans op fouten. Het verkleint ook de mogelijkheid dat overtuigingen van één reviewer de beslissingen beïnvloeden, wat bias kan veroorzaken.
Voor Cochrane reviews is werken in parallel verplicht bij beslissingen over de inclusie van de studies en bij het verzamelen van uitkomstdata. Verder is het is zeer wenselijk bij het verzamelen van informatie over studiekarakteristieken (MECIR criteria: C39, C45, C46). Werken in parallel verhoogt de kwaliteit van je systematische review.
68 Wat zijn de MECIR-standaarden?
MECIR staat voor ‘Methodological Expectations of Cochrane Intervention Reviews’. Dit zijn methodologische standaarden voor Cochrane protocollen, reviews en updates, die beschrijven hoe je zo’n review moet uitvoeren en beschrijven. Deze standaarden hebben betrekking op systematische reviews van interventies.
De standaarden geven auteurs van Cochrane systematische reviews duidelijke en transparante richtlijnen over alle stappen van het proces. Ze zijn ook nuttig voor auteurs van niet-Cochrane reviews, omdat ze beschrijven hoe je een review van hoge kwaliteit kunt maken.
Meer informatie: https://methods.cochrane.org/mecir

69 Valkuilen bij subgroepanalyses
Subgroepanalyses onderzoeken heterogeniteit, bijv. of het effect van een behandeling varieert op basis van bepaalde kenmerken van een populatie, zoals leeftijd, of op basis van kenmerken van de behandeling, zoals de dosis. Ze beantwoorden ook onderzoeksvragen die zich richten op specifieke groepen deelnemers of behandelingen.
Er zijn beduidende problemen met dit soort analyses:
- Studies rapporteren zelden resultaten voor specifieke subgroepen van deelnemers, bijvoorbeeld het effect bij personen van een bepaalde leeftijd. Veel studies kunnen daarom niet worden gebruikt in standaard meta-analyses van subgroepen.
- Subgroepanalyses zijn observationeel onderzoek, omdat ze niet meer gebaseerd zijn op een vergelijking waarbij mensen willekeurig toegewezen worden aan de ene of de andere groep.
- Hoe meer subgroepanalyses worden uitgevoerd, hoe groter de kans dat je vals-positieve of vals-negatieve resultaten verkrijgt.
Door deze valkuilen kunnen resultaten van subgroepen misleidend zijn. Als je resultaten van subgroepanalyses als heel zeker interpreteert, kan dit tot verkeerde aanbevelingen voor de praktijk leiden. Patiënten krijgen dan behandelingen die eigenlijk niet werken, of krijgen geen behandelingen die in het echt effectief zijn.
Subgroepanalyses moeten vooraf worden gepland, als onderdeel van het protocol, en voorzichtig geïnterpreteerd. Om verschillen tussen subgroepen te onderzoeken beveelt Cochrane een formele statistische benadering aan.
Bron: Deeks JJ, Higgins JPT, Altman DG (editors) on behalf of the Cochrane Statistical Methods Group. Chapter 9: Analysing data and undertaking metaanalyses. In: Higgins JPT, Churchill R, Chandler J, Cumpston MS (editors), Cochrane Handbook for Systematic Reviews of Interventions version 5.2.0 (updated June 2017), Cochrane, 2017. Available from www.training.cochrane.org/handbook.

70 Cochrane gemeenschap: Cochrane reviewgroepen en hun netwerken
Als je een Cochrane systematische review wil schrijven, benader je best de reviewgroep die het meest past bij je onderzoeksvraag. Reviewgroepen bestaan uit meerdere personen die reviewauteurs ondersteunen bij het voorbereiden, onderhouden en updaten van Cochrane reviews. Hun specifieke taak is het geven van feedback op drie producten van een review: de titel, het protocol en de uiteindelijke review. Ze controleren bijvoorbeeld of de review relevant is voor mensen die een beslissing over een bepaalde interventie moeten nemen, en of de review voldoet aan de eisen die Cochrane stelt. Reviewgroepen richten zich op een bepaald gezondheidsgebied.
Reviewgroep-netwerken verbinden reviewgroepen met als doel om de efficiëntie en tijdigheid van Cochrane reviews te verbeteren, en dan vooral de meest relevante reviews voor personen die een beslissing moeten nemen over een bepaalde interventie.
Hieronder staan de acht Cochrane netwerken met de daarin gelinkte reviewgroepen.
- Acute and Emergency Care: Acute Respiratory Infections; Anaesthesia; Bone, Joint and Muscle Trauma; Emergency and Critical Care, Injuries
- Brain, Nerves and Mind: Common Mental Disorders; Dementia and Cognitive Improvement; Developmental, Psychosocial and Learning Problems; Drugs and Alcohol, Epilepsy; Movement Disorders; Multiple Sclerosis and rare Diseases of the CNS; Neuromuscular; Schizophrenia
- Cancer: Breast cancer; Childhood Cancer; Colorectal cancer; Gynaecological; Neuro-oncology and Orphan cancers; Haematological and Malignancies; Lung cancer; Urology cancer
- Children and families: Cystic Fibrosis and Genetic Disorders; Fertility Regulation; Gynaecology and Fertility; Incontinence; Neonatal; Pregnancy and Childbirth; Sexually Transmitted Infections
- Circulation and Breathing: Airways; Heart; Hypertension; Stroke; Vascular
- Long-term conditions and Ageing: Hepato-Biliary; Inflammatory Bowel Disease; Kidney and Transplant; Metabolic and Endocrine Disorders; Upper GI and Pancreatic Diseases
- Musculoskeletal, Oral, Skin and Sensory: Back and Neck; Ear, Nose and Throat; Eyes and Vision; Musculoskeletal; Oral Health; Pain, Palliative and Supportive Care; Skin; Wounds
- Public Health and Health Systems: Consumers and Communication; Effective Practice and Organization of Care; Infectious Diseases; Public Health; Tobacco Addiction; Work
71 Cochrane gemeenschap: Cochrane velden
Cochrane bestaat uit 11 thematische velden die zich richten op brede dimensies van gezondheidszorg, zoals de zorgsetting (eerstelijnszorg), de gebruiker (kinderen, ouderen), of de zorgverstrekker (verpleegkundigen).
Deze velden hebben tot doel Cochrane als bron van wetenschappelijk bewijs te promoten, en het stimuleren van de verspreiding van Cochrane reviews binnen dat specifieke domein. Zij hebben ook tot doel kennis en ideeën uit te wisselen. Deze velden kunnen zich ontwikkelen tot een wereldwijd netwerk van stakeholders en personen betrokken bij de productie, verspreiding en implementatie van een evidence-based zorgproces.
Deze velden zijn:
- Cochrane Child Health
- Cochrane Complementary Medicine
- Cochrane Consumer Network
- Cochrane First Aid
- Cochrane Global Ageing
- Cochrane Insurance Medicine
- Cochrane Neurosciences
- Cochrane Nursing Care
- Cochrane Nutrition
- Cochrane Pre-hospital and Emergency Care
- Cochrane Primary Care
- Cochrane Rehabilitation
https://www.cochrane.org/about-us/our-global-community/fields
72 Cochrane gemeenschap: Cochrane methode groepen
Cochrane methode groepen ontwikkelen specifieke methoden voor Cochrane Reviews. Bijvoorbeeld, als je je wilt richten op neveneffecten van een behandeling, als je kwalitatief bewijsmateriaal wil gebruiken, of als je geïnteresseerd bent om ‘equity’ (billijkheid tussen personen) in de review op te nemen. Je kan terecht op de websites van de relevante methode groepen en er veel nuttige informatie vinden. Je kan deze groepen ook benaderen met specifieke vragen.
Momenteel zijn er 17 groepen:
- Adverse Effects Methods Group
- Bias Methods Group
- Comparing Multiple Interventions Methods Group
- Economics Methods Group
- Equity Methods Group
- GRADEing Methods Group
- Information Retrieval Methods Group
- IPD Meta-Analysis Methods Group
- NRS for Interventions Methods Group
- Patient Reported Outcomes Methods Group
- Priority Setting Methods Group
- Prognosis Methods Group
- Prospective Meta-Analysis Methods Group
- Qualitative and Implementation Methods Group
- Rapid Reviews Methods Group
- Screening and Diagnostic Tests Methods Group
- Statistics Methods Group
https://www.cochrane.org/about-us/our-global-community/methods-groups
73 Nieuwe onderwerpen in het Cochrane Handboek: billijkheid (equity)
Gezondheidsongelijkheid zijn verschillen in gezondheid binnen of tussen bepaalde groepen mensen. Deze verschillen hebben een groter effect op benadeelde mensen. Gezondheidsongelijkheid is vermijdbaar en oneerlijk. Een voorbeeld is het sociaaleconomische verschil in het voorkomen van astma bij kinderen als gevolg van ongelijke verdeling van luchtverontreinigende stoffen. Het vergroten van de billijkheid (“equity") wat betreft gezondheid is een belangrijke beleidsdoelstelling.
Reviewers nemen steeds vaker billijkheid wat betreft gezondheid mee in hun review. Reviewers kunnen bijvoorbeeld billijkheid overwegen bij het formuleren van hun onderzoeksvraag, of de mogelijke implicaties nagaan voor hun ‘Summary of Findings’ tabel. De methode groep ‘Equity’ geeft nuttige informatie over hoe billijkheid op te nemen in een systematische review. Personen met een Archie account kunnen ook het hoofdstuk hierover in het nieuwste Cochrane Handbook lezen. Is billijkheid iets om te overwegen voor uw review?

74 Moet ik studies die geen relevante uitkomsten rapporteren uitsluiten van mijn systematische review?
Studies die geen relevante uitkomsten rapporteren moeten niet uitgesloten worden van systematische reviews (zie ook MECIR-standaard C8). Als een studie geen uitkomsten rapporteert, betekent dit niet dat de studie deze uitkomsten niet heeft gemeten. Informatie over andere uitkomsten kan beschikbaar zijn via de auteurs.
Dit heeft te maken met uitkomstrapporteringsbias (outcome reporting bias), dit is bias die ontstaat doordat statistisch significante resultaten een grotere kans hebben om te worden gerapporteerd, terwijl de kans hierop juist lager is bij statistisch niet-significante resultaten. Uitkomstrapporteringsbias is een belangrijke bedreiging voor de validiteit van systematische reviews.

